高铁酸钾降解苯胺的效能与机理*
2010-10-23刘亚男徐冰洁
刘亚男,薛 罡,董 娟,徐冰洁
(东华大学 环境科学与工程学院,上海 201620)
高铁酸钾降解苯胺的效能与机理*
刘亚男,薛 罡,董 娟,徐冰洁
(东华大学 环境科学与工程学院,上海 201620)
采用次氯酸钾法制备高铁酸钾,并用于降解水中的苯胺.通过对比试验证明高铁酸钾对苯胺的去除效果远优于单用三氯化铁絮凝剂及次氯酸钾氧化剂,其最佳反应条件为:在高铁酸钾投量与苯胺的摩尔比为1∶1,p H值=3.0~9.0,反应时间为20 min的条件下,苯胺的去除率可达80%以上.根据高铁酸钾降解苯胺的产物光谱分析可知,高铁酸根首先对苯环上的NH2发起攻击,通过一系列反应生成偶氮苯等中间产物,这些中间产物有一部分可被开环并继续被氧化成为烷烃及烯烃等脂肪烃,但反应后残余的偶氮苯等中间产物依然是微生物难降解物质.高铁酸钾应用于难降解苯胺废水生物处理的预处理,可以有效去除废水中苯胺,并在一定程度上改善苯胺废水的可生化性.
高铁酸钾;苯胺;降解;中间产物
高铁酸钾是一种强氧化剂,可以有效降解常规氧化剂难以降解的有机物[1-2],同时由于其还原产物Fe(Ⅲ)具有无毒及絮凝的特点而受到越来越多的关注[3-7].近年来,国内外有关高铁酸钾的制备、对各种污染物去除效能及机理等方面已开展较多研究[8-13],但有关高铁酸钾去除苯胺的研究鲜见报道.
苯胺属剧毒化学品,苯胺废水主要产生于制药、印染、塑料、石油等化工过程,如不经有效处理或由于突发事故进入水环境,将会对水环境产生严重污染[14-20];且苯胺具有稳定的苯环结构,常规方法难以取得满意的处理效果[21-23].本文应用自制的高铁酸钾对水中苯胺进行降解试验,分析苯胺降解过程的影响因素及机理,探索高铁酸钾对水中苯胺的降解性能.
1 材料与方法
1.1 高铁酸钾的制备
采用次氯酸钾法制备高铁酸钾,此法与传统湿式氧化法相比绕过了中间产物高铁酸钠而直接制得高铁酸钾.控制体系反应温度在10℃左右,当ClO-初始质量浓度为137.3 g/L,铁盐投加量为化学计量的30%时,可得到纯度为96.4%的高铁酸钾晶体.
用红外光谱(FIRT)、X射线衍射(XRD)和扫描电镜(SEM)对所获的高铁酸钾晶体进行定性分析.FIRT分析结果表明,在 808 cm-1波数位置出现了一个强而宽的特征吸收峰,781 cm-1处有一肩峰,为高铁酸钾晶体中的FeO 键v3(F2)的伸缩振动特征峰.XRD分析图谱表明,图谱中分别在 2θ为 17.12°,20.84°,23.06°,29.04°,30.04°,30.46°,34.68°,35.60°和 42.48°等位置出现有高铁酸钾的特征衍射峰,2θ和晶间距 d值的测试结果与标准衍射卡其各特征衍射峰的峰位基本一致,无杂质峰,属于正交晶系结构.SEM分析结果表明,所获得的晶体形态饱满,外形为柱状,晶粒两端有明显的锥形生长面,与其属β-高铁酸钾型正交晶系的晶胞一致.证明产物是纯度较高的高铁酸钾晶体.
1.2 试验方法
用100 m L烧杯装一定体积的苯胺溶液,加入一定量自制的高铁酸钾固体,以磁力搅拌器搅拌,用稀硫酸调p H值,充分混合反应,絮凝沉降后静置,对上清液进行分析.化学需氧量(CODCr)浓度测定采用重铬酸钾标准法,苯胺的浓度测定用N-(1-萘基)乙二胺偶氮光度法.用紫外-可见分光光度计测试高铁酸钾处理苯胺后上清液紫外吸收峰的变化.用红外-拉曼光谱仪(FIRT)分析处理后滤渣的成分变化,用离子色谱仪、气相色谱和质谱联用(GC/M S)分析降解产物成分及分子结构.
2 结果与讨论
2.1 高铁酸钾投加量对苯胺去除的影响
在50 m L质量浓度为62.04 m g/L的苯胺溶液中,分别加入不同量的高铁酸钾,在p H值=7及反应时间为30 m in的条件下,上清液苯胺、CODCr去除率随高铁酸钾与苯胺摩尔比的变化如图1所示.
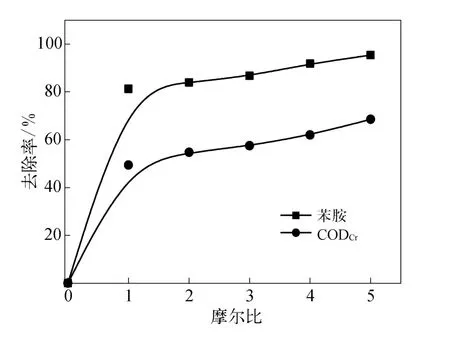
图1 高铁酸钾投加量对苯胺去除率的影响Fig.1 Effect of K2 FeO4 dose on an iline removal ratio
由图1可见,高铁酸钾与苯胺摩尔比从0至1变化时,苯胺的去除率上升较为显著,摩尔比为1时去除率已达到81.25%.随着高铁酸钾用量的增加,苯胺去除率继续上升但变化较为平缓,摩尔比为4∶1~5∶1时苯胺的去除率由达91.74%升高至95.39%;同时,CODCr去除率从49.4%升至62%,也呈稳步上升的趋势.在相同的高铁酸钾溶液投加量及反应时间下,CODCr去除率比苯胺去除率低30%~40%,说明中间产物的氧化降解速率比苯胺要慢.从分子结构来看N H2作为给电子基团连在苯环上,形成Pл共轭,加大了苯环电子云密度,因而易于被亲电氧化剂攻击.从节省药剂角度考虑,选择摩尔比为1∶1投加高铁酸钾最为适宜.
2.2 p H值、反应时间对苯胺去除的影响
取50 mL质量浓度为62.04 mg/L的苯胺水溶液,控制初始p H值为7,高铁酸钾与苯胺的摩尔比为1∶1,用磁力搅拌器搅拌使苯胺与高铁酸钾充分接触,随反应时间取样.测定溶液苯胺和CODCr浓度,得到反应时间对苯胺去除率影响曲线如图2所示.
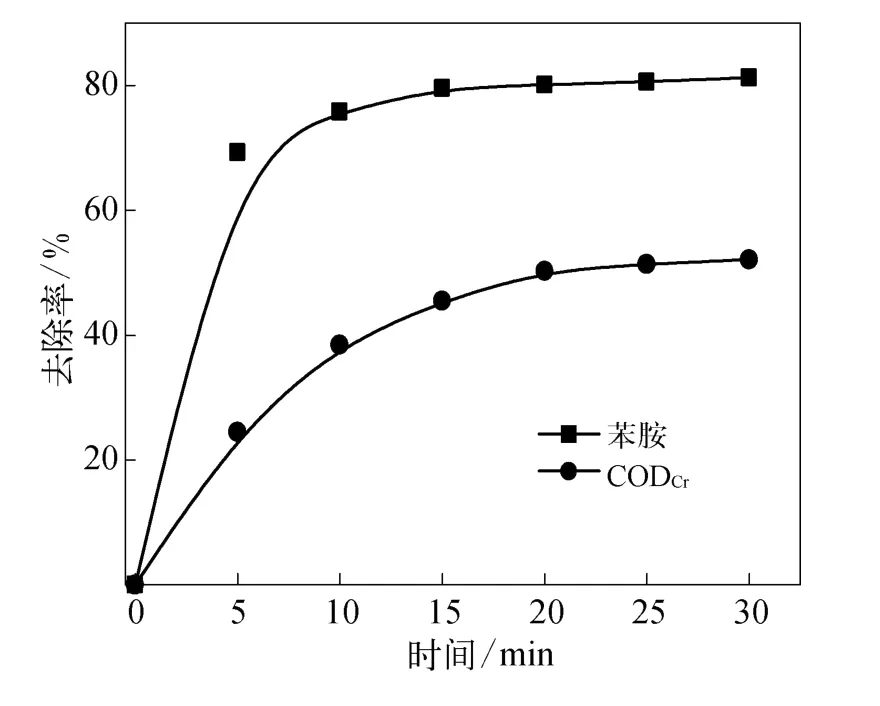
图2 反应时间对苯胺去除率的影响Fig.2 Effect of reaction time on aniline removal ratio
从图2可以看出,反应开始5 min内苯胺质量浓度变化最为明显,去除率陡增至69.3%,随后去除率一直随反应时间的延长而持续升高.反应时间为10 min时,苯胺和CODCr去除率分别能达到75.8%和38.47%;反应时间为20 min时,高铁酸钾对苯胺和CODCr的去除率可达80.13%和50.3%.但随着时间的进一步延长,苯胺和CODCr去除率增长趋于平缓,因此,确定最佳反应时间约为20 min.
取一组50 m L质量浓度为62.04 mg/L的苯胺水溶液,按照摩尔比为1∶1加入高铁酸钾固体,调节p H值至不同,得苯胺和CODCr降解率如图3所示.
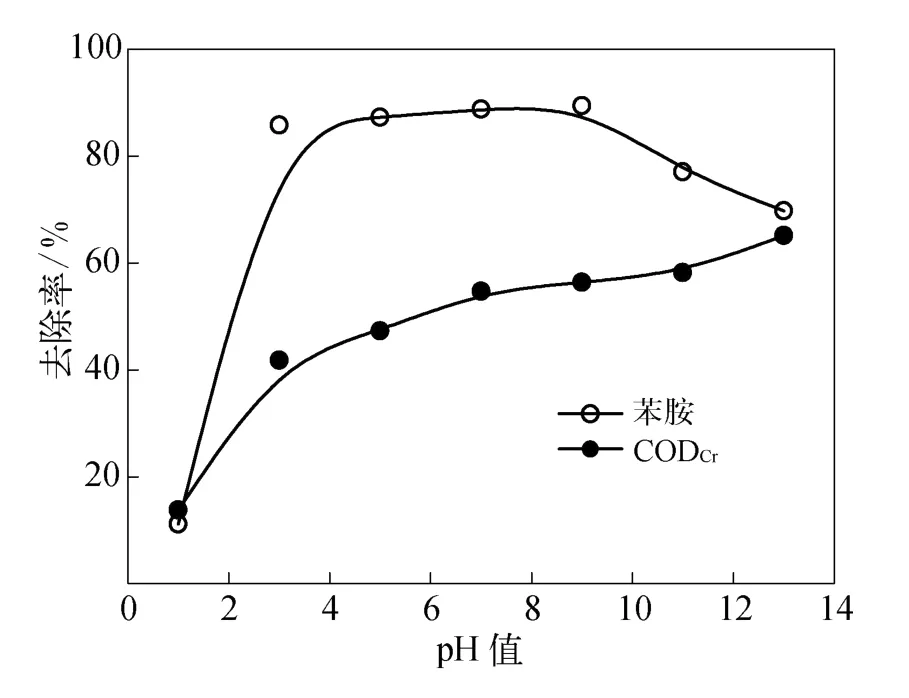
图3 p H值对苯胺去除率的影响Fig.3 Effect of pH value on aniline removal ratio
由图3可见,反应时间为20 min,p H值=1.0时,高铁酸钾对苯胺和 CODCr去除率均较低,这可能是由于在强酸性条件下高铁酸钾不稳定,大部分的高铁酸钾还未来得及与苯胺接触反应就完全分解.随着p H值升高,高铁酸钾稳定性增强,在p H值=3.0~9.0时,高铁酸钾对苯胺的去除率稳定且高达90%左右.当反应体系p H值>9.0时,苯胺去除率随p H值升高而下降,主要是因为p H值偏高使高铁酸钾氧化还原电位降低所致;但在p H值>9.0的反应过程中CODCr去除率却呈现持续上升趋势,与苯胺去除率变化规律有所不同,推断可能是在p H值较高条件下,高铁酸钾的还原产物Fe2O3对苯胺降解中间产物有较好的絮凝作用所致,因此苯胺的去除率虽然降低,但 CODCr去除率却升高.实验结果表明高铁酸钾降解苯胺的最适宜p H值为3.0~9.0.
2.3 高铁酸钾与絮凝剂氯化铁、氧化剂次氯酸钾去除苯胺的对比研究
为了进一步证明高铁降解苯胺过程中,强氧化性所起的重要作用,采用单纯氯化铁研究简单的混凝过程对苯胺的去除.表1为碱性条件下,固定氯化铁和苯胺摩尔比为10∶1,改变p H值而测定的氯化铁对苯胺的混凝效果.在25 m L质量浓度为110.75 mg/L的苯胺溶液中,投加100 m g氯化铁进行混凝试验,苯胺去除率最高仅达19.38%,而仅投加7 mg的高铁酸钾并反应30 min,苯胺就可以去除60%以上.
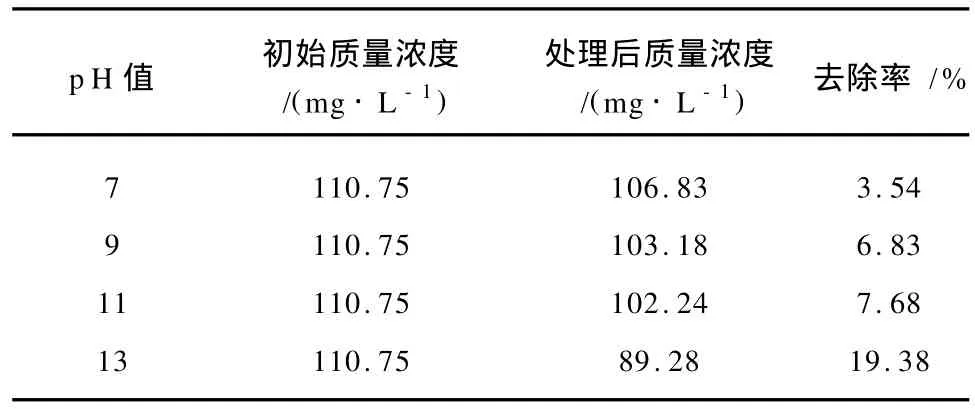
表1 单纯氯化铁絮凝对苯胺的去除效果Table 1 Removal effect of FeCl3 on aniline
对初始质量浓度为90.12 mg/L的苯胺溶液,分别采用次氯酸钾与高铁酸钾进行降解苯胺的对比试验.投加不同量的次氯酸钾和高铁酸钾,考察对苯胺的降解,结果如图4所示.对比高铁酸钾和次氯酸钾氧化降解苯胺发现,高铁酸钾对苯胺去除率比次氯酸钾略高,随着氧化剂投加量的增加,苯胺去除率逐渐升高,高铁酸钾和次氯酸钾对苯胺去除率相差越小.
2.4 高铁酸钾降解苯胺产物分析
如图5所示为p H值=8的碱性条件下水中的苯胺经高铁酸钾降解前后的紫外光谱图.由于苯环上的一个氢原子被NH2取代,苯环的B吸收带(λmax为 256 nm)红移 ,出现λmax为 280 nm 的吸收峰 ,E2吸收带(λmax为 204 nm)红移 ,出现λmax为230 nm的吸收峰.从图5可以看出,经高铁酸钾降解后,苯胺的特征吸收峰已消失,同时出现一系列新的吸收峰,即降解过程中生成一些中间产物;与高铁酸钾反应前后,紫外吸收光谱最显著的差异是:反应后在320 nm处有较强的吸收峰,这是中间产物偶氮苯的吸收峰,说明在偏碱性条件下易于生成偶氮苯等中间产物,这与后续在碱性条件下氧化苯胺时气相色谱和质谱联用(GC/M S)分析得到偶氮苯的结果相吻合.
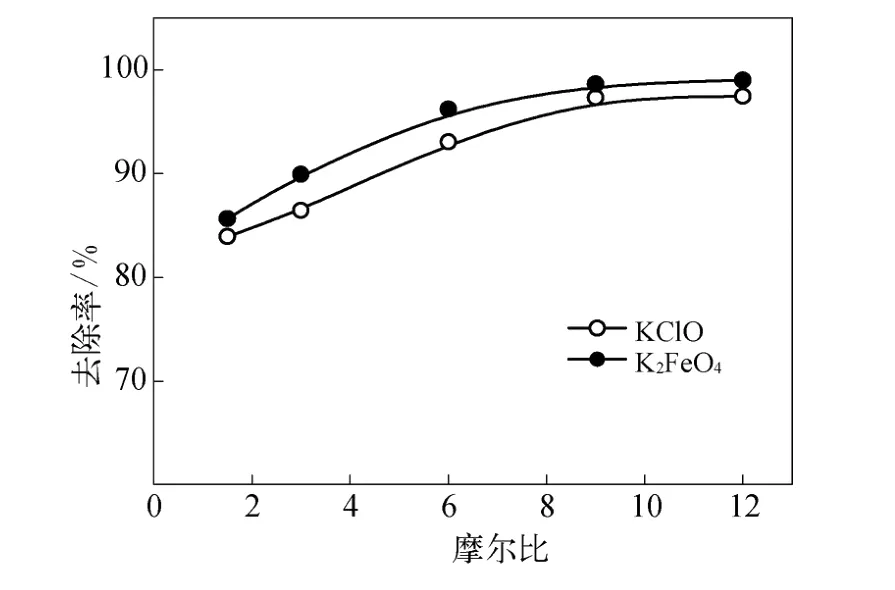
图4 高铁酸钾与次氯酸钾降解苯胺效能对比Fig.4 Com parison of the removal effect on aniline between K2 FeO4 and KClO

图5 苯胺降解液的紫外吸收光谱Fig.5 UV-Vis spectrum of aniline degradation solution
图6为苯胺的红外谱图,对高铁酸钾与苯胺反应后的滤渣进行红外光谱测试,得到红外谱图如图7所示.
从图6可以看到,在波数为3 300~3 500 cm-1处有两个由NH 伸缩振动引起的苯胺的特征吸收峰,另外在 1 560~1 650 cm-1处有两个由NH 面内弯曲振动引起的强吸收峰,在1 250~1 340 cm-1区域有CN 伸缩振动的强吸收峰,在650~900 cm-1区域有 NH 面外弯曲振动的强宽峰.从图7可以看出,苯胺经高铁酸钾降解后谱峰已变得很单一,苯胺的吸收峰消失,1 632 cm-1处为烯烃的吸收峰,1 344 cm-1处为烷基的吸收峰,说明苯胺开环后降解产物在滤渣中有小分子的烯烃和烷烃结构;另外,在1 118 cm-1和618 cm-1处为硫酸盐的吸收峰,是在加硫酸调p H值时引入并以晶体的形态存在于滤渣中的硫酸盐;454 cm-1处为Fe2O3的吸收峰,是高铁酸盐被还原的产物.
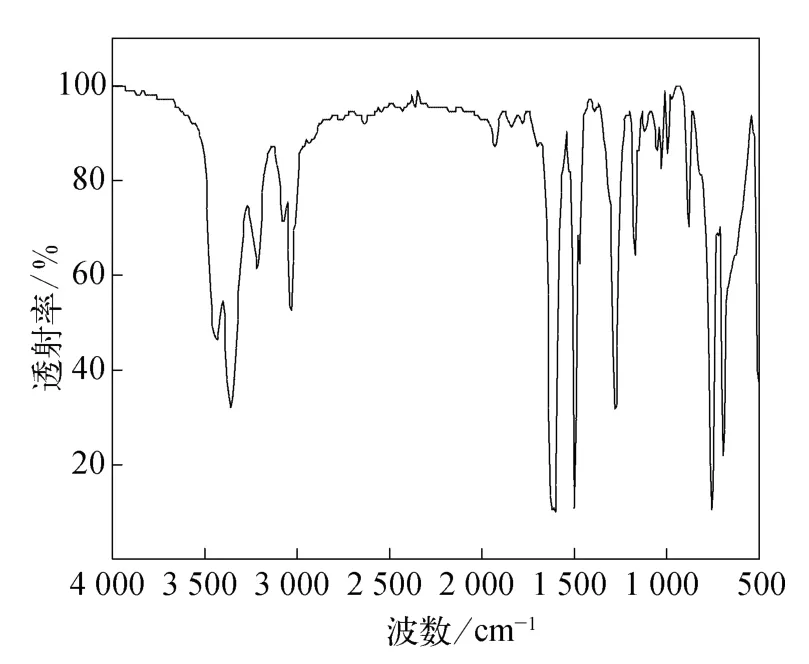
图6 苯胺的红外光谱图Fig.6 FIRT of aniline
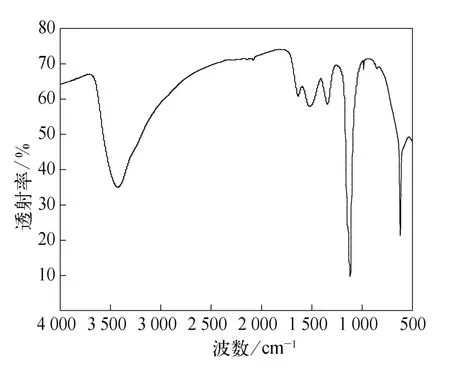
图7 滤渣的红外光谱图Fig.7 FIRT of filter residue
将苯胺降解后上清液进行 GC/M S分析,以确定苯胺分解产物,结果如图8所示.GC/M S结果表明,高铁酸钾与苯胺反应后生成一系列偶氮苯等中间产物,但在上清液中未检出上述滤渣红外光谱检出的烯烃和烷烃等脂肪烃类物质,推断其主要原因是 GC/M S样品处理过程用时较长,所生成烯烃和烷烃被高铁酸钾彻底氧化成CO2和H2O.
综合上述高铁酸钾降解苯胺产物的紫外吸收光谱、红外光谱及 GC/M S的分析结果,推断苯胺降解机理为:高铁酸根对苯环上的NH2发起攻击,通过一系列反应生成偶氮苯等中间产物,这些中间产物中有一部分可被开环并继续被氧化成为烷烃及烯烃等脂肪烃.反应如下所示:
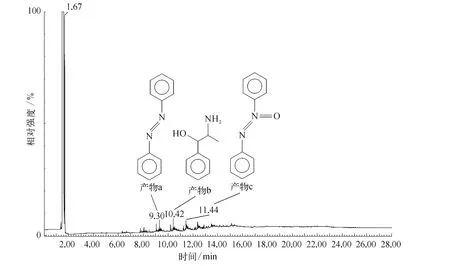
图8 苯胺降解液色-质谱图Fig.8 GC/MS spectrum of aniline degradation solution
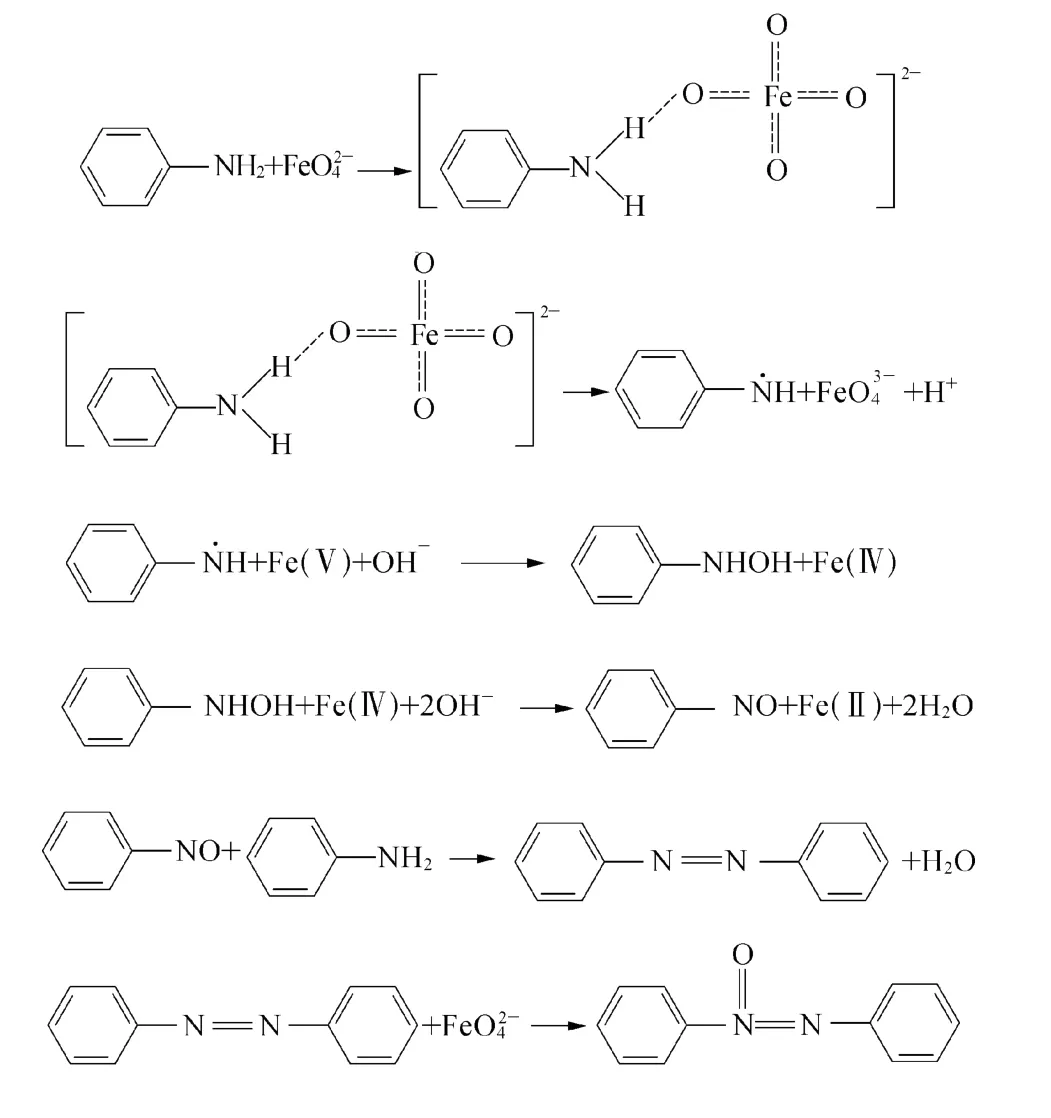
3 结论
(1)采用高铁酸钾降解水中的苯胺,通过试验探明了高铁酸钾降解水中的苯胺的最佳反应条件:高铁酸钾与苯胺投量的摩尔比为 1∶1,p H值=3.0~9.0,反应时间为20 m in,苯胺的去除率可达80%以上.且高铁酸钾对苯胺去除效果优于单用三氯化铁絮凝剂及次氯酸钾氧化剂.
(2)通过紫外吸收光谱、红外光谱、GC/M S对高铁酸钾降解苯胺的产物进行分析,确定高铁酸钾降解水中的苯胺反应机理为:高铁酸根对苯环上的N H2发起攻击,通过一系列反应生成偶氮苯等中间产物,这些中间产物有一部分可被开环并继续被氧化成为烷烃或烯烃等脂肪烃.
(3)高铁酸钾首先可以将稳定的苯胺降解为偶氮苯等中间产物,其中一部分中间产物可以继续被氧化分解为脂肪烃,脂肪烃类物质,易于被后续的废水生物处理进一步彻底降解为CO2和 H2O,但反应后残余的偶氮苯等中间产物依然是微生物难降解物质.因此,高铁酸钾应用于难降解苯胺废水生物处理的预处理,虽然可以有效去除废水中苯胺并改善苯胺废水的可生化性,但由此产生的部分偶氮苯等中间产物的进一步的降解机理及最佳反应条件,尚待进一步研究.
[1] DELAUDE L,LASZLO P.A Novel Oxidizing Reagent Based on Potassium Ferrate(Ⅵ)[J].Journal of Organic Chemistry,1996,61(23):6360-6370.
[2] JIANG J Q,LLOYD B.Progress in the Development and Use of Ferrate(Ⅵ)Salt as an Oxidant and Coagulant for Water and Wastewater Treatment[J].Water Research,2002,36(15):1397-1408.
[3] VIRENDER K S.Potassium Ferrate(Ⅵ):An Environmentally Friendly Oxidant[J].Advances in Environmental Research,2002,6(5):143-156.
[4] KHALILZADEH M A,HOSSEINIA,SADEGHIFAR H,etal.Rapid and Efficient Oxidation of Hantzsch 1,4-dihydropyridines with Potassium Ferrate under Microwave Irradiation[J].Acta Chimica Slovenica,2007,54(4):900-902.
[5] JIANG J Q,PANAGOULOPOULOS A,BAUER M,etal.The Application of Potassium Ferrate for Sewage Treatment[J].Journal of Environmental Management,2006,79(2):215-220.
[6] SHARMA V K,M ISHRA S K,RA Y A K.Kinetic Assessment of the Potassium Ferrate(Ⅵ)Oxidation of Antibacterial D rug Sulfamethoxazole [J].Chemosphere,2006,62(1):128-134.
[7] 姜洪泉,于秀娟,王鹏.高铁酸钾预氧化去除水中苯酚及其机理[J].中国给水排水,2003,19(8):47-48.
[8] 陆晶,黄丽,邵春雷,等.高铁酸钾氧化降解罗丹明(RhB)水溶液的研究[J].环境化学,2007,26(3):366-370.
[9] 邓子峰,喻赛芳,胡婷婷.高铁酸钾降解苯酚的机制研究[J].环境污染与防治,2007,29(12):905-911.
[10] 刘伟,马军.高铁酸钾预氧化处理受污染水库水[J].中国给水排水,2001,17(7):70-73.
[11] 曲久辉,林谡,田宝珍.高铁氧化去除饮用水中邻氯苯酚的研究[J].环境科学学报,2001,21(6):701-704.
[12] JIANG J Q,WANG S,PANAGOULOPOULOS A.The Role of Potassium Ferrate(Ⅵ)in the Inactivation of Escherichia Coli and in the Reduction of COD for Water Remediation[J].Desalination,2007,210(1/2/3):266-273.
[13] JIANG J Q,WANG S,PANA GOULOPOULOS A.The Exp lo ration of Potassium Ferrate(Ⅵ)as a Disinfectant/Coagulant in Water and Wastewater Treatment [J].Chemosphere,2006,63(2):212-219.
[14] GITI E,MOHAM AD S. The Utilization of Aniline,Chlorinated Aniline and Aniline Blue as the Only Source Nitrogen by Fungi in Water[J].Water Research,2001,35(5):1219-1224.
[15] 张欣,董秀芹,张敏华.催化超临界水氧化苯胺[J].化工进展,2007,26(3):413-416.
[16] 黄辉,艾飞虎,马淳安,等.催化氧化法处理含难降解有机物废水研究进展[J].浙江工业大学学报,2002,30(5):470-474.
[17] Q I X H,ZHUANG Y Y.Decomposition of Aniline in Supercritical Water[J].Jou rnal of Hazardous M aterial,2002,90(22):51-62.
[18] O'NEILL F J,BROM LEY-CHALLENOR K C A.Bacterial Grow th on A niline:Imp lications for the Biotreatment of Industrial W astew ater[J].Water Research,2000,34(18):4397-4409.
[19] 韩瑜.低温苯胺降解菌的特性及生物强化作用[D].哈尔滨:哈尔滨工业大学市政环境工程学院,2007.
[20] 雷彩虹.加压生化法处理苯胺废水的研究[D].杭州:浙江工业大学环境学院,2008.
[21] BH IN IA F,SA HA N C,KAVIRAJ A.Effects of Aniline—an Aromatic Amine to Some Freshwater Organism s[J].Eco toxicology,2003,12(7):397-407.
[22] 刘海峰,刘元.UV/H2O2微曝气处理微污染水中苯胺的试验研究[J].供水技术,2008,2(6):15-17.
[23] 富楠,涂学炎,潘媛,等.水热电催化氧化法降解高浓度苯胺废水[J].环境化学,2007,27(5):578-582.
Study on Degradation of Aniline by Potassium Ferrate
LIU Ya-nan,XUE Gang,DONG Juan,XU Bing-jie
(School of Environmental Science and Engineering,Donghua University,Shanghai201620,China)
Potassium ferrate was made by the potassium hypochlorite method and w as used to degrade aniline in water.According to the comparative experiments,the potassium ferrate was mo re effective to degrade aniline than the flocculant ferric chloride and the oxidant potassium hypochlo rite.The aniline removal ratio was more than 80%under the optimum reaction conditions for aniline degradation by potassium ferrate:themolar ratio of potassium ferrate to aniline 1∶1,p H value 3.0-9.0 and reaction time 20 m in.Based on the analysis of aniline degradation products,ferrate(Ⅵ)ion firstly attack at–N H2on benzene,producing azobenzene and other compounds by series of reaction.Part of those compounds could be opened rings and oxidized to aliphatic hydrocarbon compounds,but the remained azobenzene is also recalcitrant formicroorganisms to degrade.Potassium ferrate oxidation is an effective method to remove aniline from water to increase the aniline wastewater biodegradability.
potassium ferrate;aniline;degradation;intermediates
X 703.1
A
2009-10-19
教育部新世纪优秀人才计划(NECT-07-0175);上海市基础研究重点项目(08JC1400500);教育部博士点基金新教师项目(200802551001);长江水环境教育部重点实验室开放基金项目(YRW EF08003);上海市自然科学基金(10ZR1401100)
刘亚男(1978—),女,黑龙江东宁人,副研究员,博士,研究方向为水污染控制.E-mail:liuyanan@dhu.edu.cn
薛 罡(联系人),男,教授,E-mail:xuegang@dhu.edu.cn
1671-0444(2010)03-0288-06
