反刍动物瘤胃微生物氨同化作用研究进展
2010-04-17王芃芃谭支良
王芃芃 谭支良
(1.中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,长沙 410125; 2.中国科学院研究生院,北京 100049)
反刍动物虽可以消化粗饲料,但其中的含氮物质的利用率较低,摄入蛋白质仅有不到20%能够被转化为畜产品[1]。而当饲喂高蛋白质饲粮时,动物机体的消化能力较强,瘤胃微生物合成效率较弱,两者之间的不平衡又成为限制反刍动物提高饲粮氮素转化效率的主要因素[2]。因此,瘤胃内微生物的蛋白质合成机理及其利用效率一直是反刍动物蛋白质营养研究领域的热点。
反刍动物饲料中的蛋白质,40%~80%被瘤胃微生物降解成氨。且对于大多数瘤胃微生物而言,氨是其生长所必需的首选氮源。有研究认为瘤胃细菌和原虫蛋白质中的氮有70%和50%分别来源于氨[3]。瘤胃微生物利用氨合成微生物蛋白质(m icrobial protein,MCP),其生物合成效率与瘤胃内氨的浓度和总量密切相关,且进入反刍动物后肠道的MCP通常占非氨氮总量的34%~89%[4]。然而,尽管瘤胃内氨浓度变化受到多种因素影响,但氨的产量始终远大于瘤胃微生物利用氨合成自身蛋白质的总量。而过量的氨则以被动扩散或主动吸收的方式被机体吸收,并主要通过肝脏转化成尿素流失到体外[5]。氮素的大量流失不仅造成排泄物对环境的污染,而且造成十分宝贵的蛋白质资源利用效率较低。目前的研究主要是通过优化饲粮结构来提高反刍动物饲粮氮转化率。然而,瘤胃内各类微生物利用氮源的机理并不十分明晰,仅通过饲粮调控途径提高瘤胃MCP合成效率是相当有限的。为此,充分了解瘤胃微生物利用氮素尤其是氨合成MCP的反应过程,并探讨瘤胃微生物同化氨的分子机制,将从本质上为调控并提高反刍动物氮利用率提供关键科学依据。
1 反刍动物瘤胃微生物氨同化作用进程
瘤胃微生物种类繁多、数量庞大,主要包括细菌、真菌、原虫和噬菌体等。几类微生物间相互作用,形成了一个精密的微生态系统,对饲料营养物质进行着复杂的消化、吸收和代谢。其中,瘤胃原虫不能直接利用瘤胃氨合成氨基酸,是瘤胃氨的净生产者,而瘤胃细菌和真菌则可直接利用瘤胃氨合成MCP,满足其自身生长需求。
1.1 瘤胃微生物氨同化作用概述
瘤胃微生物对于瘤胃氨的利用主要是通过氨化和转氨作用完成。大量试验表明,瘤胃微生物内普遍存在的2条主要氨同化反应路径:1)谷氨酸脱氢酶(glutamate dehydrogenase,GDH)路径,即α-酮戊二酸和氨在GDH参与下生成谷氨酸;2)谷氨酰胺合成酶-谷氨酸合成酶复合酶系(glutam ine synthetase-glutamate synthase,GS-GOGAT)路径,即谷氨酸和氨在GS作用下生成谷氨酰胺,而谷氨酰胺和α-酮戊二酸又可在GOGAT的作用下生成谷氨酸(图1)。2条路径的终产物均是谷氨酸,其在瘤胃游离氨基酸池中的以氨氮从头合成的氨基酸中含量是最高的。
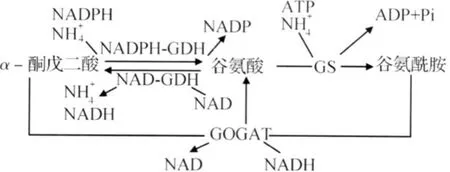
图1 瘤胃微生物GDH和GS-GOGAT代谢路径Fig.1 The GDH and GS-GOGAT metabo lic pathw ays of rumen m icroorganisms
除上述2条主要路径外,瘤胃微生物氨同化作用还存在着其他路径。Burchall等[6]在以瘤胃非纤维分解菌Streptococcus bovis为研究对象的纯培养试验中,并未检测到GS的存在,而是提纯得到了天冬酰胺合成酶(asparagine synthetase,AS)。之后, Blake等[7]应用同位素15N标记氨技术,提出AS路径可能是瘤胃细菌同化氨的另一条重要路径。且在高氨浓度下,丙氨酸作为该路径下的终产物,常以瘤胃游离氨基酸池中的优势氨基酸被检测到[8]。
此外,于革兰氏阴性纤维分解菌——产琥珀酸丝状杆菌中发现的丙氨酸脱氢酶(alanine dehydrogenase,ADH)路径是除GDH路径外瘤胃细菌同化氨的另一条重要路径。而且在该菌中也未能检测到GS,且认为其功能由AS代替[9]。
其中,GDH和ADH系统被认为是瘤胃微生物氨同化作用过程中与氨低亲和性的系统,而GSGOGAT系统则被认为是与氨高亲和性的系统。换而言之,一般情况下,低氨浓度时,GS-GOGAT系统发挥主要功效;高氨浓度时,GDH和ADH的功能占主导地位。
1.2 瘤胃细菌氨同化作用
据统计,每毫升瘤胃内容物中含有细菌1010~1011个,这使得瘤胃细菌在瘤胃微生物中占据数量优势。目前已分离鉴定的瘤胃细菌有200多种,在瘤胃发酵过程中的各个方面发挥着重要作用[10]。
记忆中,在我4岁那年,由中国国际电视总公司出品了一部41集古装神话剧——改编自明代小说家吴承恩同名文学古典名著《西游记》。1986年春节一经播出便轰动全国,可谓老少皆宜,获得了极高评价。至今仍是寒暑假期间被重播最多的电视剧之一,百看不厌,成为一部公认的、无法超越的经典。该剧讲述的是孙悟空、猪八戒、沙僧辅保大唐高僧玄奘(唐僧)去西天取经的故事,师徒四人一路抢滩涉险,降妖伏怪,历经九九八十一难,取回真经,终修成正果的故事。
瘤胃细菌可根据净碳水化合物-蛋白质体系(CNCPS)分为发酵结构性碳水化合物的细菌和发酵非结构性碳水化合物的细菌。普遍认为,前者仅能利用氨作为其生长所需氮源,后者则可利用氨、氨基酸和肽共同作为其生长所需氮源[11]。
1.2.1 发酵结构性碳水化合物的瘤胃细菌氨同化作用
结构性碳水化合物主要包括纤维素、半纤维素和木质素。瘤胃纤维分解菌对氨氮的利用主要是通过GDH路径和ADH路径完成。氨同化作用过程中,关键酶的活性受氨浓度影响较大,但因菌种的不同存在着一定的差异。
Duncan等[12]通过批次培养和连续培养试验得到Ruminococcus flavefaciensFD-1氨同化作用过程中的主要参与酶是GDH和GS,在氨氮受限制的培养基中酶活性较高。M orrison等[13]以R.flavefaciens和蛋白质分解菌Prevotella rum inicola为研究对象验证了GDH路径是这2种瘤胃细菌同化氨的主要路径。但在P.rum inicola中,GDH活性受肽浓度调节,与氨浓度无关。
M atheron等[9]以核磁共振技术研究Fibrobacter succinogenesS85碳氮代谢关系时提出,参与氨同化作用的2个主要作用酶是GDH和ADH。于细胞抽提物中并未检测到GS。谷氨酰胺经由AS路径合成。NAD-GDH和NADP-GDH均存在反应活性,且其表达量不受低氨浓度的限制。丙酮酸和氨在NADPH-ADH的作用下合成丙氨酸,然而并未检测到其逆反应的发生。此外,应用分光光度计和核磁共振技术检测到谷氨酸-丙酮酸转氨酶(glutamate-pyruvate transam inase,GPT)和谷氨酸-草酰乙酸转氨酶(g lutam ate-oxaloacetate transam inase,GOT)的活性很高。
纤维分解菌不能在没有氨的培养基中存活,但是氨基酸的加入可以刺激其生长、提高其纤维降解率,而肽的加入使得纯纤维分解菌在以纤维二糖为底物的培养基上生长更为迅速[14]。A tasoglu等[15]以瘤胃3种纤维分解菌Rumincoccus albusSY 3、R.flavefaciens17和F.succinogenesBL2为研究对象得出,氨氮在细胞氮中的比例随其他氮源浓度的增加而减少。当培养基中肽浓度为1 g/L时,平均80%的细胞氮来源于氨氮。当培养基中其他氮源浓度较高时,如胰蛋白酶达到10 g/L或者氨基酸浓度达到15.5 g/L时,3种纤维分解菌的细胞氮中非氨氮的氮所占比例分别为46%、43%和51%。且纤维二糖比纤维素做底物更有利于氨氮的利用。
1.2.2 发酵非结构性碳水化合物的瘤胃细菌氨同化作用
非结构性碳水化合物可分为水溶性碳水化合物(包括单糖、双糖、低聚糖和一些多糖)和不溶于水的大分子多糖。非纤维分解菌对氨氮的利用主要是通过GDH路径和GS路径完成,可以从头合成多种自身所需氨基酸,且大多数不存在GOGAT路径。
Patterson等[16]以Succinivibrio dextrinosolvensC18和C24 2个菌株为试验对象,同时进行连续培养。在限制氨氮浓度的培养基中,GS和尿酶活性较高,而GDH活性较低,表明此种状况下GS路径是氨同化作用过程中的主要路径;而在高氨浓度培养基中,GS活性锐减,尿酶、GDH和丙酮酸激酶活性不变。相似的,瘤胃非纤维分解菌Selenomonas ruminantium在低氨浓度培养基中,氨同化作用关键酶亦是GS,GDH活性虽然较低但并未被抑制[17]。然而在Ruminobacter amylophilus中,GS高表达的同时GDH活性却被抑制[18],且2种菌均为检测到GOGAT活性。高氨浓度培养基中,S.bovis的GDH活性亦显著高于GS活性[19]。
在氨浓度范围为0.045~0.436 g N/L的培养基中分别对3种瘤胃非纤维分解菌Prevotella bryantiiB1 4、S.ruminantiumHD4和S.bovisES1进行纯培养试验。随着培养基中氨浓度的递增,P.bryantii和S.ruminantium2种菌中氨氮在细胞氮和氨基酸氮中所占比例逐渐增加,而在S.bovis中,除氨浓度极低情况下,氨氮在微生物蛋白氮中所占比例基本保持不变。3种非纤维分解菌利用氨氮从头合成的氨基酸量最大的是谷氨酸和天冬氨酸,之后是丝氨酸和赖氨酸(P.bryantii)、丝氨酸和苏氨酸(S.ruminantium)、丝氨酸和丙氨酸(S.bovis)。脯氨酸合成量最低,之后是苯丙氨酸(P.bryantii)、赖氨酸(S.ruminantium)、脯氨酸和苯丙氨酸以及异亮氨酸(S.bovis)。此现象与S.bovis为淀粉分解菌以及不同氮源的选择性转运和氨同化作用过程中的不同作用酶的活性存在差异有
关[20]。
1.3 瘤胃厌氧真菌氨同化作用概述
瘤胃厌氧真菌是反刍动物瘤胃纤维分解微生物类群中的重要组成成员。较纤维分解菌而言,瘤胃厌氧真菌缺乏蛋白质降解能力。在缺乏氨基酸的培养基中,可以以氨为唯一氮源合成自身所需氨基酸满足生长需求[21]。但外源氨基酸可以刺激其生长,其中赖氨酸是限制其生长的主要氨基酸[20]。GDH路径和GS-GOGAT路径是瘤胃真菌同化氨的2条主要反应路径。
2 反刍动物瘤胃微生物氨同化作用的关键酶
瘤胃微生物利用氨合成MCP是在许多酶的参与下完成的。Erfle等[22]利用瘤胃混合菌进行连续培养试验得出,GS-GOGAT在正常瘤胃氨浓度情况下活性很低,但当氨浓度极低时该系统的酶活性很高。ADH的米氏常数(Km)为70mmol/L,在氨浓度极高的情况下该酶发挥着固定氨的作用。而AS和天冬氨酸转氨酶(aspartate am inotransferase)的活性不受瘤胃内氨浓度的影响。
2.1 GDH
瘤胃微生物中提取得到的GDH分为NADGDH和NADP-GDH。前者用于降解谷氨酸,后者用于谷氨酸的合成[23]。据报道,NAD-GDH多存在于R.albus和Pep tostrep tococcus elsdenii中; NADP-GDH多存在于S.bovis、R.flavefaciens、Bacteroides succinogenes、Bacteroides amylophilus、S.ruminantium和Butyrivibrio fibriso lvens中。部分瘤胃细菌体内既含有NADH-GDH又含有NADPH-GDH,两者常常在量上相当,但后者的酶活性往往更高。
Duncan等[24]纯化鉴定了R.flavefaciensFD-1中的GDH。该酶和它的亚基大小分别为280和48 ku,为六聚体。此酶为NADP(H)依赖型,达到其最佳活性时需要0.5 mol/L KC l,最适pH为6.9~7.0。以N端序列为寡聚核苷酸探针可用于克隆和分离GDH基因。
Erfle等[22]在对瘤胃混合菌进行连续培养试验时观测到:人工瘤胃发酵初接种时,NAD-GDH和NADP-GDH活性均降低,2种蛋白量相当;连续培养4 d后酶活性恢复,在氨同化作用中占据主导地位。天冬氨酸和谷氨酸浓度不随氨浓度变化。氨浓度较低时,瘤胃微生物倾向于合成丙氨酸和甘氨酸。当氨浓度较高时,丙氨酸浓度上升的很快,说明丙氨酸可能是氨的一个储存载体,也可能是为了转化为葡萄糖前体。
2.2 GS
GS是许多含氮化合物合成过程中重要的第一步反应关键酶。瘤胃氨和谷氨酸在GS的作用下生成谷氨酰胺,需要ATP水解提供的能量和阳离子团的参与[25]。GS在氨同化作用过程中发挥着极其重要的作用,是潜在的药物靶点。
系统发育研究证明编码GS的基因是现存的最古老的功能性基因之一。GS蛋白家族可分为3个类型:GSⅠ、GSⅡ和GSⅢ。Ⅰ型主要分布于细菌;Ⅱ型主要分布于与植物共生的细菌以及真核细胞中;Ⅲ型首先发现于专性厌氧类杆菌中,后在一些厌氧细菌和蓝细菌中发现。研究R.albus8假定基因glnN侧翼序列得出,该基因下游121核苷处有一个融合于基因glnK中的编码胺转运酶(am tB)的开放阅读窗[26]。
GS活性既受到氨浓度调节又受其他因素影响。高氨浓度下,GS活性往往锐减。但是用缓冲液冲洗培养基中的细胞,或者在培养基中添加蛇毒磷酸二酯酶均可使GS活性恢复。S.dextrinosolvens在限制氨浓度培养基中,锰离子的加入可以抑制其GS活性,而在高氨浓度(15 mmo l/L)培养基中培养过后锰的加入将刺激GS活性[16]。Masclaux-Daubresse等[27]以烟草为研究对象时指出,蛋氨酸亚砜酰亚胺可以极大地抑制GS活性,而不影响GDH的氨化和脱氨基作用。
2.3 GOGAT
GOGAT最初发现于非瘤胃细菌中,可将1分子谷氨酸与1分子α-酮戊二酸反应生成2分子谷氨酸,该过程将NADPH转化成NADP。Erfle等[22]利用瘤胃混合菌进行连续培养试验中,检测到了该酶的存在。
3 反刍动物瘤胃微生物氨同化作用调控
反刍动物瘤胃微生物以饲粮蛋白质降解产生的氨、肽和氨基酸为氮源,以饲粮有机物发酵产生的挥发性脂肪酸和ATP分别为碳架和能量合成MCP的过程,受到诸多因素调控。如饲粮碳源组成、不同氮源、瘤胃微生物的细胞膜通透性和氨同化作用酶的活性。
瘤胃内的氨浓度可以从饲喂低氮饲粮时的1mmol/L到饲喂高氮饲粮时的瞬时浓度40mmol/L,变化幅度很大[28]。然而每种瘤胃微生物对氨氮的利用量却变化不大。Li等[29]研究发现氨转运蛋白(AM Ts)广泛存在于古细菌、细菌、真菌、植物和动物中,是氨的重要转运载体。古细菌和细菌中的AMTs,能特异性地转运NH4+和协同转运NH3/H+,即借助AM Ts细菌能够逆浓度梯度转运NH3[30]。
H ungate[31]率先提出饲粮碳水化合物的组成和浓度影响瘤胃微生物对氨及饲粮氮源的利用。与以大豆蛋白质为氮源的绵羊相比,饲喂尿素的绵羊瘤胃细菌抽提物中,尿酶、谷氨酸-草酰乙酸转氨酶和谷氨酸-丙氨酸转氨酶以及GDH的活性均较低,说明饲粮氮源类型影响瘤胃微生物种群及其生存环境,进而影响到瘤胃氮素代谢[32]。
肽和氨基酸同样影响氨同化作用。纯培养非纤维分解菌P.bryantiiBa4、S.rum inantiumHD4、S.bovisES1的研究显示,氨基酸和肽的加入使得氨同化作用合成的氨基酸种类和数量发生变化。其中,较其他氨基酸(甚至是丙氨酸)而言,谷氨酸和天冬氨酸总是大量从头合成[33]。而且,非纤维分解菌细胞氮和氨基酸氮中来源于氨氮的量随培养基中肽和氨基酸浓度的增加而减少[34]。
4 小 结
瘤胃细菌利用氨合成自身所需氨基酸是一个复杂精密的反应过程,此过程受到多种因素影响,使得瘤胃混合菌或者单个菌种在不同条件下利用氨的能力存在一定差异。瘤胃细菌对瘤胃内环境及自身状况的“感知”、细菌细胞膜从外环境中对优势氮源的筛选以及合成自身蛋白质的过程中关键酶的交替均受到严格的调控,有待进一步的研究。只有从根本上明确反应机制,才能大幅度改善反刍动物的蛋白质营养转化率。
[1] MACREA JC.Advancing our understanding am ino acid utilization and metabolism in rum inant[M]// KORNEGAY E T.Nutrient m anagem ent o f food animals to enhance and p rotec t the environment. Boca Raton:CRC Press Inc.,1996:73-89.
[2] DUDA G D,HANDLER P.K inetics of ammoniametabolismin vivo[J].The Journal of Biological Chem istry,1957,232:303-314.
[3] ARCHIBEQUE S L,BURNS JC,HUNTINGTON G B.Urea flux in beef steers:effects of forage species and nitrogen fertilization[J].Journal o f Animal Science,2001,79:1937-1943.
[4] SHABIZ,TAGARI H,MURPHY M R,et al.Partitioning of am ino acids flowing to the abomasum into feed,bacterial,p rotozoal,and endogenous frac tions [J].Journal o f Dairy Science,2000,83:2326-2334.
[5] TAN Z L,M URPHY M R.Ammonia production, ammonia absorp tion,and urea recycling in rum inants(a review)[J].Journal of Anim al and Feed Sciences,2004,13:389-404.
[6] BURCH ALL J J,REICHELT E C,WOLIN M J. Purification and p roperties o f the asparagine synthetase o fStrep tococcus bovis[J].The Journal of Bio logical Chem istry,1964,239(6):1794-1798.
[7] BLAKE JS,SALTER D N,SM ITH R H.Incorporation o f nitrogen into rum en bac terial fractions of steers given p rotein-and urea-containing diets.Ammonia assim ilation into intracellular bacterial am ino acids[J].British Journal o f Nutrition,1983,50: 769-782.
[8] W ALLACE R J,COTTA M A.M etabolism of nitrogen containing com pounds[M]//HOBSON P N. The rumen m icrobial ecosystem.London:Blackie A cadem ic&Professional,1988:217-249.
[9] MATHERON C,DELORT A M,GAUDETG,et al. Interaction between carbon and nitrogen metabolism inFibrobacter succinogenesS85:a1H and13C nuclear magnetic resonance and enzymatic study[J].M icrobiology,1999,65(5):1941-1948.
[10] RUSSELL JB,RUIZ R,ALBRECHTG L,et al. Ef fec t ofm onensin on the performance and nitrogen utilization o f lac tating dairy cows consum ing fresh forage[J].Journal o f Dairy Science,2001,84: 1717-1727.
[11] RUSSELL JB,CONNOR JD,FOX D G,et al.A net carbohydrate and p rotein system for evaluating cattle diets:Ⅰ.Rum inal fermentation[J].Journal of Animal Science,1992,70(11):3551-3561.
[12] DUNCAN P A.Ammonia assim ilation byRum inococcus flavefaciensFD-1[D].Illinois:University of Illinois,Urbana-Cham paign,1993.
[13] MORRISON M,MACK IE R I.Nitrogen metabolism by rum inalm icroorganism:curren t understanding and future perspective[J].Australian Journal of Agricultural Research,1996,47:227-246.
[14] BRYANTM P,ROBINSON IM.Studies on the nitrogen requirements of some rum inal cellulolytic bacteria[J].App lied M icrobiology and Biotechnology,1961,9:96-103.
[15] ATASOGLU C,NEWBOLD C J,WALLACE R J. Incorporation of15N-ammonia by the cellulolytic rum inal bacteriaFibrobacter succinogenesBL2,Rum incoccus albusSY3,andRum incoccus flavefaciens17[J].Applied and Environmental M icrobiology, 2001,67(6):2819-2822.
[16] PATTERSON J,HESPELL R B.Glutam ine synthetase activity in the rum inal bacteriumSuccinivibrio dextrinosolvens[J].App lied and Environm ental M icrobiology,1985,50(4):1014-1020.
[17] SMITH C J,HESPELL R B,BRYANT M P.Regulation o f urease and amm onia assim ilatory enzymes inSelenomonas rum inantiun[J].App lied and Environmental M icrobiology,1981,42:89-96.
[18] JENK INSON H F,BUTTERY P J,LEWIS D.Assim ilation o f ammonia byBacteroides amylophilusin the chemostat cultures[J].Journal of General M icrobiology,1979,113:305-313.
[19] GRIFFITH C J,CARLSSON J.Mechanism o f ammonia assim ilation inStreptococci[J].Journal of GeneralM icrobio logy,1974,82:253-260.
[20] ATASOG LU C,W ALLACE R J.De novo synthesis of am ino acids by the rum inal anaerobic fungi,Piromyces communisandNeocallimastix fronta lis[J]. FEMSM icrobiology Letters,2002,212:243-247.
[21] LOW E S E,THEODOROU M K,TRINCI A P J, et al.G row th o f anaerobic rumen fungi on defined and sem i-defined media lacking rum en fluid[J]. Journal o f General M icrobiology,1985,131:2225-2229.
[22] ERFLE JD,SAUER F D,MAHADEVAN S.Effect o f ammonia concentration on activity o f enzymes of amm onia assim ilation and on synthesis of am ino acid bym ixed rum en bac teria in continuous culture[J]. Journal o f Dairy Science,1976,60(7):1064-1072.
[23] PHIBBSP V Jr,BERNLOHR R W.Purification, p roperties and regulation of glutam ic dehydrogenase ofBacillus licheniform is[J].Journal of Bacteriology,1971,106(2):375-385.
[24] DUNCAN P A,WH ITE B A,MACKIE R I.Purification and properties of NADP-dependent glutamate dehydrogenase fromRuminococcus flavefaciensFD-1[J].Applied and Environmental M icrobiology, 1992,39:4032-4037.
[25] ALMASSY R J,JANSON C A,HAM LIN R,et al. Novel subunit-subunit interaction in the structure of glutam ine synthetase[J].Nature,1986,323:304-309.
[26] AMAYA K R,KOCHERGINSKAYA S A,MACKIE R I,etal.Biochem ical andmutational analysis of g lutam ine synthetase typeⅢfrom the rumen anaerobeRum inococcus albus8[J].Bacteriology,2005, 187(21):7481-7491.
[27] MASCLAUX-DAUBRESSE C,REISDORF-CREN M,PAGEAU K,et al.G lutam ine synthetase-glutam ate synthase pathway and glutamate dehydrogenase p lay distinct roles in the sink-sourcenitrogen cycle in tobacco[J].American Society of Plant Biologists, 2006,140:444-456.
[28] WALLACE R J,ONODERA R,COTTA M A. M etabolism of nitrogen-containing com pounds[M]// HOBSON PN,STEWART C S.The rumen m icrobial ecosystem.2nd ed.New York:Blackie Academ ic&Pro fessional,1997:238-328.
[29] LI X D,LU PD,ZHENG L,et al.Structural and functional insights into the Am tB/Mep/Rh protein fam ily[J].Transfusion Clinique Biologique,2006, 13:65-69.
[30] LUDEW IG U.Ion transport versus gas conduction: function of AM T/Rh-type proteins[J].Transfusion Clinique Biologique,2006,13:111-116.
[31] HUNGATE R E.Rumen m icrobial ecosystem[J]. Annual Review o f Eco logy and System atics,1975, 6:39-66.
[32] CHALUPA W,CLARK J,OPLIGER P,et al.Ammonia metabolism in rumen bacteria and mucosa from sheep fed soy p rotein or urea[J].Nutrition, 1969,100:161-169.
[33] ATASOGLU C,VALDÉS C,WALKER N D,et al. De novo syn thesis o f am ino acids by the rum inal bacteriaPrevotella bryantiiB14,Selenomonas rum inantiumHD 4,andStrep tococcus bovisES1[J].Applied and Environmental M icrobiology,1998,64 (8):2836-2843.
[34] ATASOG LU C,W ALLACE R J.In fluence o f ammonia concentration on15N-ammonia incorporation and de novo am ino acid synthesis by the non-celluloly tic rum inal bacteria,Prevotella bryantiiB14,Selenomonas ruminantiumHD4 andStreptococcus bovisES1[J].Turkish Journal of Veterinary and Animal Sc iences,2002,26:389-395.
*Correspond ing au thor,p rofessor,E-m ail:zltan@isa.ac.cn
(编辑 田艳明)
