响应面法优化玫瑰茄红色素提取工艺
2010-03-22曾哲灵郝纯青
曾哲灵,郝纯青,吕 伟,彭 超
(南昌大学生命科学与食品工程学院,食品科学与技术国家重点实验室,江西 南昌 330047)
响应面法优化玫瑰茄红色素提取工艺
曾哲灵,郝纯青,吕 伟,彭 超
(南昌大学生命科学与食品工程学院,食品科学与技术国家重点实验室,江西 南昌 330047)
采用单因素试验和响应面分析法(RSM)研究料液比、提取时间、提取温度对乙醇提取玫瑰茄红色素效果的影响。以提取液中总花色苷含量为响应值,通过响应面分析优化玫瑰茄红色素提取工艺条件。结果表明:影响玫瑰茄红色素提取效果的主要因素为料液比,次要因素为提取时间和提取温度。玫瑰茄红色素适宜乙醇提取工艺条件为料液比1:24.8(g/mL)、提取时间1.52h、提取温度48.74℃,相应提取液中总花色苷的含量为487.6mg/100g。
玫瑰茄红色素;提取;响应面法
玫瑰茄又名山茄、红角葵、洛神葵、山茄子等,学名Hibiscus sabdariffa Linn.,英文名malvace roselle、roselle[1],为锦葵科木槿属一年生草本植物,原产非洲,近年来在我国福建、广东、广西、云南、浙江等地有大面积种植[2]。
玫瑰茄花萼呈紫红色,其色素属花青甙类,主要是飞燕草素(delphinidin)和矢车菊素(cyanidin)的糖甙[3],与葡萄、草莓、樱桃等水果色素相同。玫瑰茄花萼中总花青苷含量为干花萼的1%~1.5%,柠檬酸、木槿酸等有机酸10%~15%,还原糖16%,蛋白质3.5%~7.9%,其他非含氮物质25%,纤维素11%,灰分12%,另含有不到1%的17种氨基酸[4]。玫瑰茄提取物中含有还原糖类、甙类、酚类、少量生物碱和树脂类等[5]。
传统医学认为,玫瑰茄花萼具有清热、解渴、止咳和降血压的作用。近年来,国内外对玫瑰茄花萼的保健功能和药理作用进行了广泛深入研究,发现玫瑰茄具有抗氧化[6]、抗肿瘤[7]、降血压[8]、保护肝脏[9]和保护心血管[10]等药理作用[3]。随着科学技术的发展,合成色素逐步被天然色素取代已是大势所趋,开发安全可靠的天然色素对保障人民身体健康具有十分重要的意义[2]。
本实验主要研究玫瑰茄红色素提取工艺及其影响因素,通过响应面分析得到其优化组合,为进一步开发利用玫瑰茄红色素提供依据。
1 材料与方法
1.1 材料与试剂
玫瑰茄干花萼 江西武功山农业开发有限公司;无水乙醇、盐酸、氯化钾、醋酸钠均为分析纯;pH4.5缓冲液[11]:1mol/L CH3COONa:1mol/L HCl:水=100:60:90 (V/V);pH1.0缓冲液:0.2mol/L盐酸溶液:0.2mol/L KCl溶液=25:67(V/V)。
1.2 仪器与设备
70目标准筛 江南筛具厂;HH-2恒温水浴锅 江苏金坛市中大仪器厂;WFZ756PC型紫外-可见分光光度计 上海光谱仪器有限公司;R6型旋转蒸发仪器 上海申生科技有限公司;SHB-Ⅲ型循环水真空泵 郑州长城科工贸有限公司;FA1604型电子天平 赛多利斯科学仪器(北京)有限公司;PHS-2F型PH计 上海精密科学仪器有限公司雷磁仪器厂。
1.3 方法
1.3.1 玫瑰茄红色素的提取
将玫瑰茄干花萼用中药粉碎机粉碎,过70目标准筛,在适宜温度下,以40%乙醇溶液[12]萃取玫瑰茄干花萼一定时间。然后过滤,收集滤液即得到玫瑰茄红色素提取液。
1.3.2 玫瑰茄红色素提取效果评价
玫瑰茄红色素提取效果以一次提取液中总花色苷含量(mg/100g)来评价。总花色苷含量的测定方法采用pH示差法[11],玫瑰茄红色素提取液浓缩后,用提取液定容至100mL,从100mL提取液中取1mL,分别用pH1.0、pH4.5的缓冲液稀释至10mL,在波长520nm处测定光密度。
参考Osawa等[13]和冯建光等[14]的方法,计算提取液中总花色苷的含量。
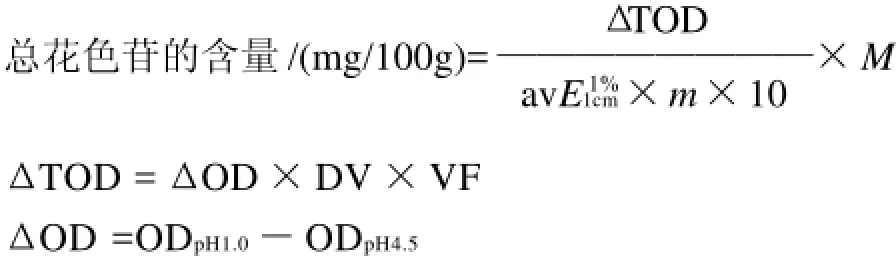
式中:DV为稀释体积/mL;VF为稀释倍数;ΔOD为光密度变化值;m为样品质量/kg;M为Cyanidin-3-glucoside的相对分子质量,449.2;ODpH1.0为pH1.0缓冲液定容的色素溶液的光密度;ODpH4.5为pH4.5缓冲液定容的色素溶液的光密度;为Cyanidin-3-glucoside消光系数,取26900。
1.3.3 测定波长的确定
取玫瑰茄红色素的提取液稀释至一定的体积,进行200~700nm全波长扫描,绘制光谱图,并与文献[15]的花色苷光谱进行比较,同时确定测定时可见光区最大吸收波长。
1.3.4 玫瑰茄红色素提取工艺条件确定
1.3.4.1 单因素试验设计
提取温度对总花色苷含量的影响:称取5份玫瑰茄干花萼粉末(每份2g),料液比1:25,乙醇体积分数40%,提取时间1h,研究不同提取温度30、40、50、60、70℃对总花色苷含量的影响。
提取时间对总花色苷含量的影响:称取5份玫瑰茄干花萼粉末(每份2g),料液比为1:25,乙醇体积分数40%,提取温度60℃,研究不同提取时间1.0、1.5、2.0、2.5、3.0h对总花色苷含量的影响。
料液比对总花色苷含量的影响:称取5份玫瑰茄干花萼粉末(每份2g),乙醇体积分数40%,提取温度60℃,提取时间1h,研究不同料液比1:15、1:20、1:25、1:30、1:35(g/mL)对总花色苷含量的影响。
1.3.4.2 响应面试验设计
在单因素试验基础上,以总花色苷含量为指标,以提取温度、料液比、提取时间3个因素为自变量,设计三因素三水平共17个试验点的响应面分析试验,优化玫瑰茄红色素提取工艺条件。
1.3.5 数据处理及分析
利用Design Expert7.0软件中的多元线性回归分析程序,拟合二阶多项式方程:
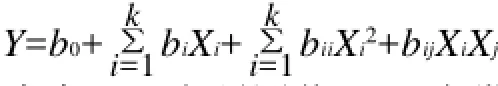
式中:Y为预测值;b0为常数项;bi为线性系数项;bii为二次项系数;bij为交互作用项系数。对回归方程的系数进行显著性比较(F检验),研究提取温度、料液比、提取时间对玫瑰茄红色素制备的影响。再利用Design Expert7.0将获得的二阶多项式方程转化为响应曲面,进一步分析试验因素及水平对响应值的影响。
2 结果与分析
2.1 测定波长确定
玫瑰茄红色素的紫外-可见扫描图谱见图1。
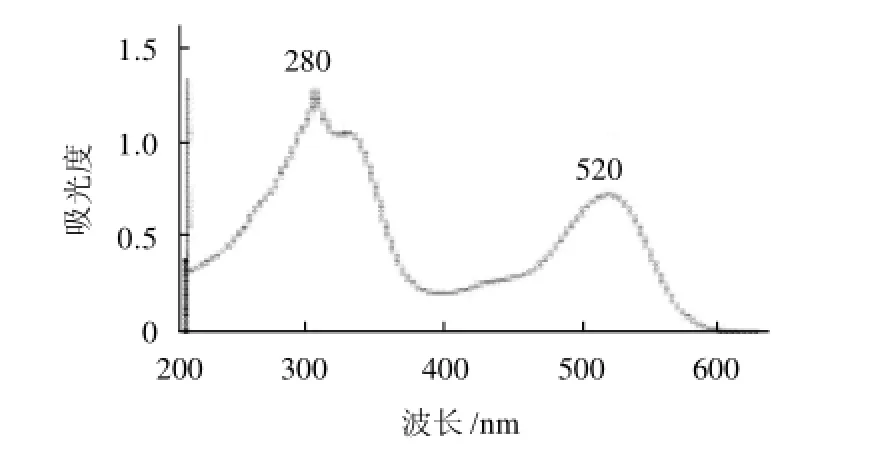
图1 玫瑰茄红色素紫外-可见扫描光谱图Fig.1 UV-visible scanning spectrum of roselle calyx red pigments
由图1可知,玫瑰茄红色素分别在280nm和520nm波长处有吸收峰。据资料报道[16],花色苷类的特征吸收光谱带在278nm附近和507~536nm范围内,认定玫瑰茄红色素属于花色苷类色素。同时选取可见光区520nm为最佳测定波长。
2.2 提取工艺参数对玫瑰茄红色素提取效果的影响
2.2.1 提取温度对总花色苷的含量的影响
从图2可见,随提取温度的升高,总花色苷含量不断增加,在50℃时总花色苷的含量增加到最高,以后就有所下降,这是因为随着温度的升高,一方面总花色苷的溶出速度增加,另一方面总花色苷在温度较高的条件下,容易发生氧化降解,温度越高,降解速度越快,图2结果是两种相反因素共同作用的结果,开始时溶出速度要大于氧化降解速度,因此在50℃以前含量是增加的,但随着温度的升高,总花色苷氧化降解速度大于溶出速度,所以50℃后,总花色苷的含量呈下降趋势。
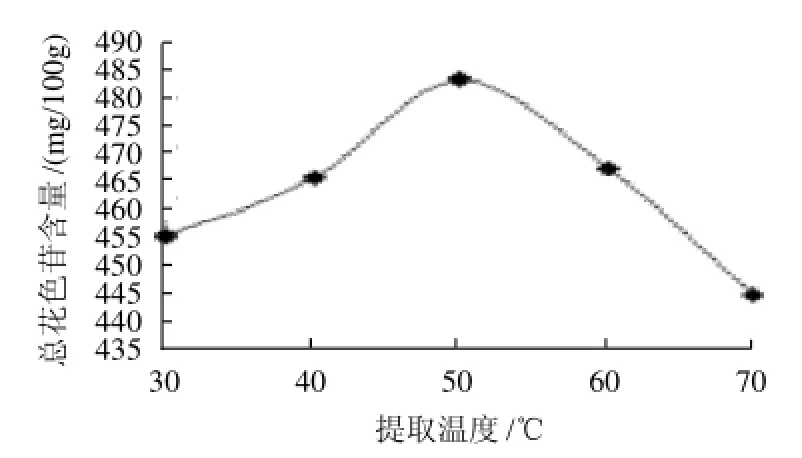
图2 提取温度对总花色苷含量的影响Fig.2 Effect of extraction temperature on the content of total anthocyanins in the extract
2.2.2 提取时间对总花色苷含量的影响
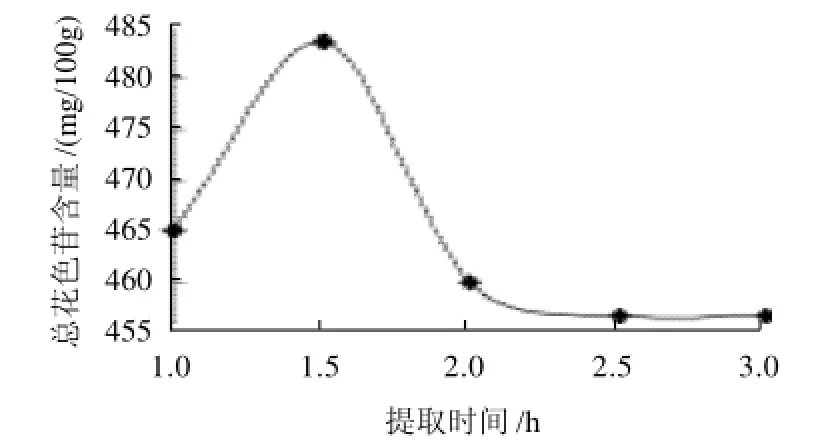
图3 提取时间对总花色苷的含量的影响Fig.3 Effect of extraction duration on the content of total anthocyanins in the extract
从图3可以看出,随提取时间的延长,总花色苷的含量先增加后降低,这是因为玫瑰茄干花萼中的总花色苷在1.5h前基本都溶出,1.5h后花色苷开始降解,含量降低。从图3可知,1.5h时总花色苷的含量最高。
2.2.3 料液比对总花色苷的含量的影响
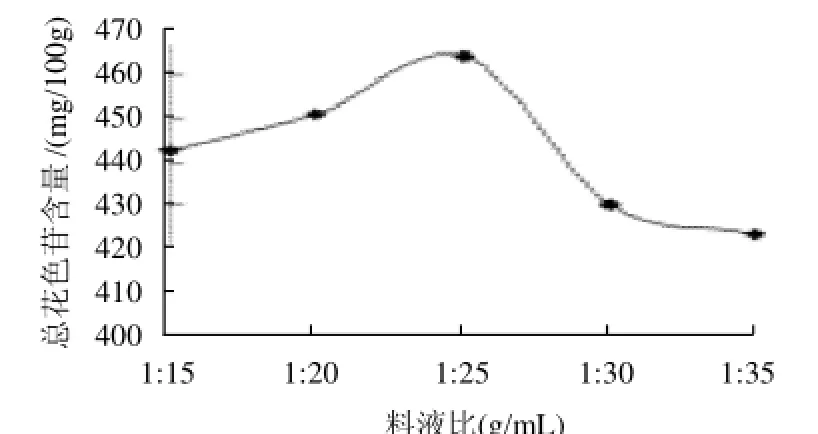
图4 料液比对总花色苷含量的影响Fig.4 Effect of material/liquid ratio on the content of total anthocyanins in the extract
从图4可知,随含水量的增加,总花色苷的含量开始增加,这是因为水量多有利于总花色苷的扩散传质,但加水量到达一定的程度后,总花色苷含量呈下降趋势,因为水量过大时,花色苷含量下降,花色苷分子间作用力变小,其稳定性下降而容易分解,所以料液比为1:25(g/mL)时,总花色苷的含量最高。
2.3 响应面试验设计和结果
在单因素试验基础上,以总花色苷含量为指标,以提取温度、料液比、提取时间3个因素为自变量,设计三因素三水平17个试验点的响应面分析试验,因素水平编码见表1,试验设计和结果见表2。

表1 中心复合旋转试验因素水平编码表Table1 Factors and levels in the central composite design
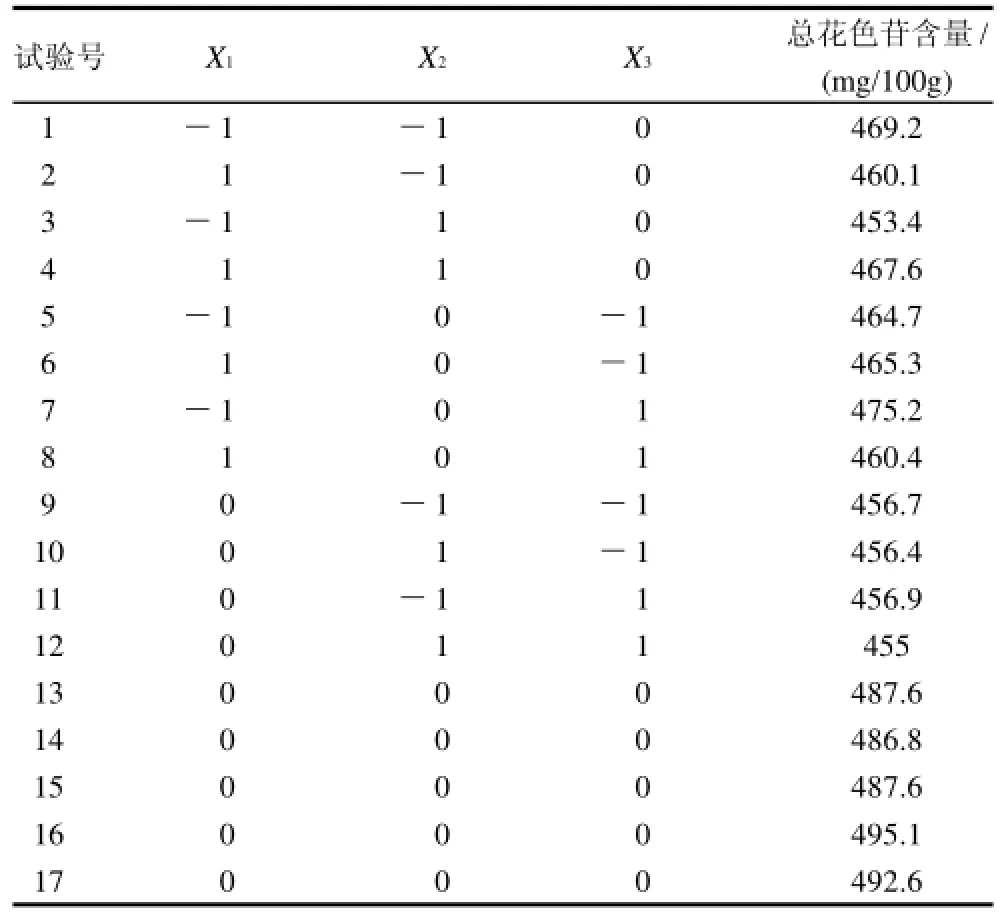
表2 中心复合旋转试验设计方案Table2 Central composite design arrangement and experimental results
2.4 响应面法试验数据处理及数值分析
为了研究不同条件对玫瑰茄红色素制备的影响和确定最佳制备条件,在单因素试验基础上进行中心组合试验(Box-Behnken),对工艺参数进行优化,试验设计方案和结果见表3,17个试验点分为两类:其一是析因点,自变量取值在X1、X2、X3所构成的三维顶点,共有12个析因点;其二是零点,为区域中心点,零点试验重复5次,用来估计试验误差。
以总花色苷含量为响应值,经回归拟合后,各试验因素对响应值的影响可以用下列函数表示:
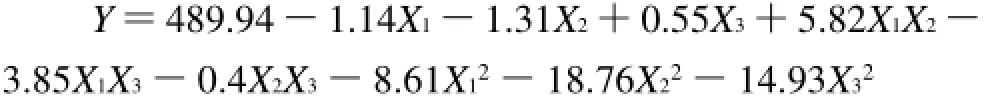
进一步对回归方程进行分析,其系数显著性结果见表3。
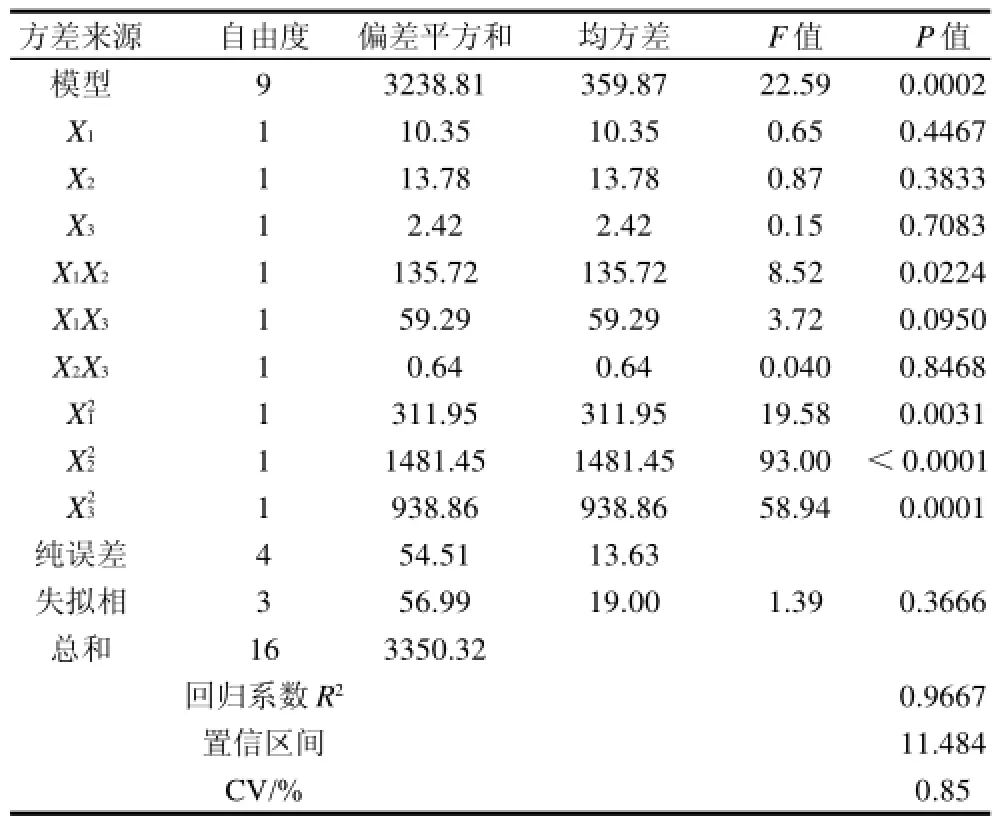
表3 回归模型方差分析Table3 Analysis of variance for the content of total anthocyanins in the extract with various extraction conditions
从表3可以看出,此模型P<0.05,响应面回归模型达到显著水平。相关系数R2=0.9667,表明96%的数据可以用这个方程解释。由表3可以看出,影响总花色苷含量的因素主次顺序为X2>X1>X3。模型中X12、X22、X32对总花色苷含量的影响极显著(P<0.01),X1X2对总花色苷含量的影响显著(P<0.05),失拟项各项数据分析表明该模型失拟不显著,因此该二次方程能够较好地拟合真实的响应面。
2.5 显著交互作用对总花色苷含量的影响
为进一步考察3个因素两两之间的交互作用对总花色苷含量的影响,对其响应面曲线以及等高线图进行分析,从图5~7中可以直观看出优化区域,并可以在优化区域内根据总花色苷提取过程中的实际需要调整各因素的数值大小,从而得到含量较高的总花色苷。
2.5.1 提取温度和料液比的交互作用
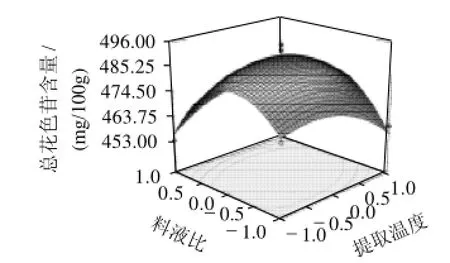
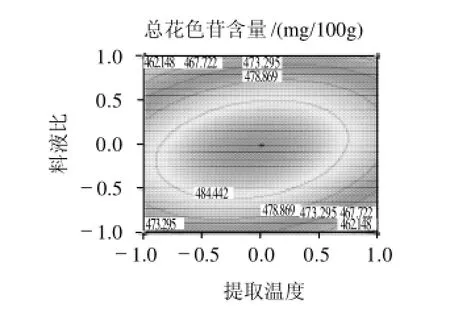
图5 总花色苷含量与提取温度和料液比之间关系响应曲面及等高线图Fig.5 Response surface and contour plots illustrating the interactive effects of extraction temperature and material/liquid ratio on the content of total anthocyanins in the extract
由图5可知,响应曲面的坡度相对较陡,表明响应值(总花色苷含量)对提取温度和料液比的改变较敏感。特别是料液比的变化对总花色苷含量的影响比提取温度变化的影响大,等高线比较密。当提取温度在48~50℃之间,料液比在1:24~1:25g/mL之间时对提高总花色苷含量最有利,其预测总花色苷含量为487.6mg/100g。
2.5.2 提取温度和提取时间的交互作用
由图6可知,响应曲面的坡度较陡,表明响应值(总花色苷含量)对提取温度与提取时间的变化较敏感。从等高线可以看出提取时间变化对总花色苷含量的影响比提取温度的变化影响大。当提取温度在48~50℃之间、提取时间在1.5~1.6h之间时对提高总花色苷含量最有利,其预测值为486.8mg/100g。
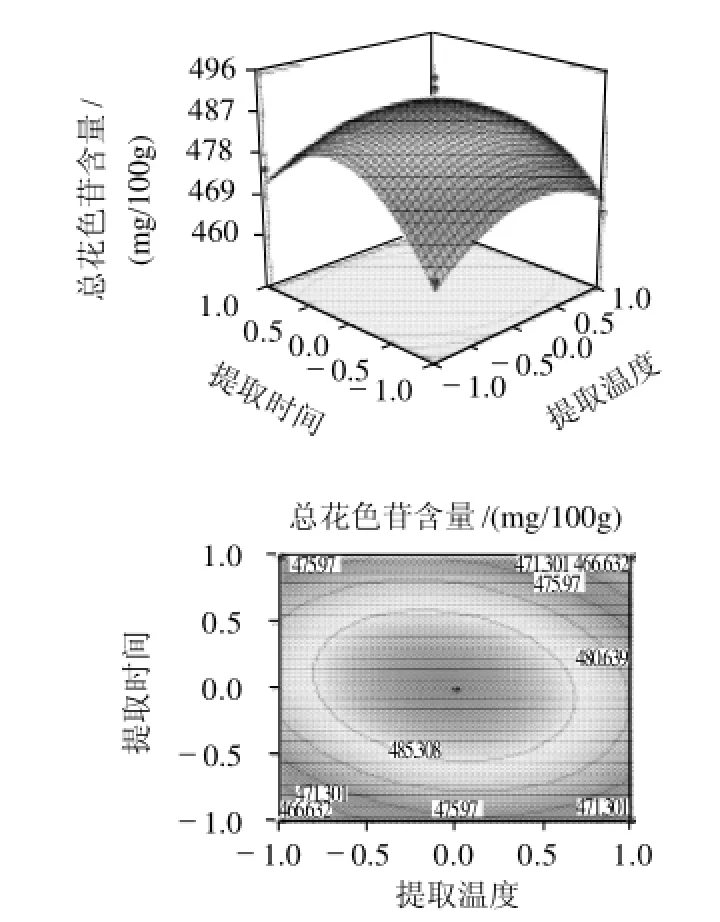
图6 总花色苷含量与提取温度和提取时间之间关系响应曲面及等高线图Fig.6 Response surface and contour plots illustrating the interactive effects of extraction temperature and duration on the content of total anthocyanins in the extract
2.5.3 料液比和提取时间的交互作用
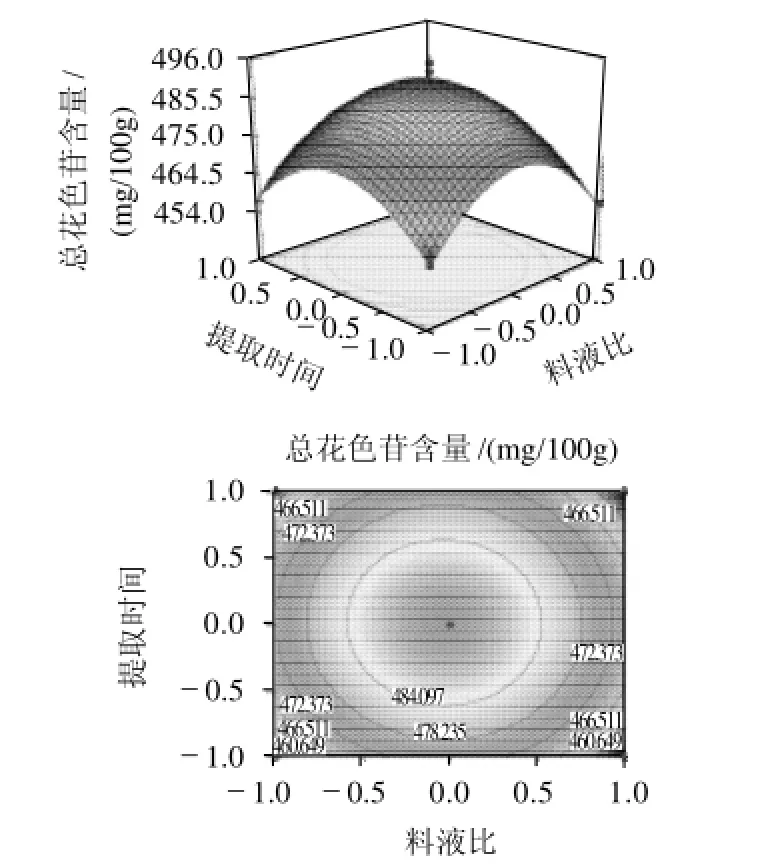
图7 总花色苷含量与料液比和提取时间之间关系响应曲面及等高线图Fig.7 Response surface and contour plots illustrating the interactive effects of extraction duration and material/liquid ratio on the content of total anthocyanins in the extract
由图7可知,响应曲面的坡度相对较平缓,表明响应值(总花色苷含量)对料液比和提取时间的交互作用不敏感。从等高线看,料液比和提取时间两者的变化对响应值的影响区别不是很大,当料液比在1:24~1:25(g/ mL)之间、提取时间在1.5~1.6h之间时对提取总花色苷含量最有利,其预测值为489.4mg/100g。
2.6 优化提取工艺参数的验证
为了进一步确证计算机模拟得到最佳点的值,对所得的回归方程取一阶偏导等于零并整理得:X1=-0.126;X2=-0.052;X3=0.035;Y=489.98。对应的试验条件:提取温度48.74℃、料液比1:24.8(g/mL)、提取时间1.52h,总花色苷含量489.98mg/100g。以所得最佳反应条件进行实验,测得总花色苷含量为487.6mg/100g,与模拟计算机值基本接近,表明预测值和真实值之间有很好的拟合性,进一步验证了模型的可靠性。
3 结 论
响应面分析法可以很好地优化玫瑰茄红色素的提取工艺,影响玫瑰茄红色素提取效果的主要因素为料液比,次要因素为提取时间和提取温度;玫瑰茄红色素的适宜提取工艺参数为料液比1:24.8(g/mL)、提取时间1.52h、提取温度48.74℃,相应提取液中总花色苷含量487.6mg/100g。本研究结果对玫瑰茄红色素的进一步纯化及开发利用具有指导作用。
[1]陈政. 玫瑰茄的开发和利用[J]. 饮料工业, 2007,10(3): 13-16.
[2]章建浩, 陈松, 刘海斌, 等. 食用玫瑰茄红色素的稳定性研究[J]. 食品科技, 2001(1): 49-55.
[3]李升锋, 刘学铭, 陈智毅, 等. 玫瑰茄花萼营养和药理作用研究进展[J]. 食品研究与开发, 2006, 27(10): 129-133.
[4]中国医学科学院药用植物开发研究所. 中国药用植物栽培学[M]. 北京: 中国农业出版社, 1991.
[5]张育松, 陈洪德, 苏孝勇. 玫瑰茄茶[J]. 福建茶叶, 2001(1): 21-22.
[6]HIRUNPANICH V, UTAIPAT A, MORALES N P, et al. Antioxidant effects of aqueous extracts from dried calyx of Hibiscus sabdariffa Linn. (Roselle) in vitro using rat low-density lipoprotein(LDL)[J]. Biol Pharm Bull, 2005, 28(3): 481-484.
[7]CHANG Yunching, HUANG Huipei, HSU Jengdong, et al. Hibiscus anthocyanins rich extract-induced apoptotic cell death in human promyelocytic leukemia cells[J]. Toxicol Appl Pharmacol, 2005, 205 (3): 201-212.
[8]MOZAFFARI-KHOSRAVI H, JALALI-KHANBADI B A, AFKHAMIARDEKANI M, et al. The effect of sour tea(Hibiscus sabdariffa)on essential hypertension in patients with type Ⅱdiabetes[J]. Journal of human hypertension, 2009, 23(1): 48-54.
[9]LIU Jeryuh, CHEN Changche, WANG Wenhong, et al. The protective effects of Hibiscus sabdariffa extract on CCl4-induced liver fibrosis in rats[J]. Food Chem Toxicol, 2006, 44(3): 336-343.
[10]CHEN Changche, HSU Jengdong, WANG Sanfa, et al. Hibiscuss sabdariffa extract inhibits the development of atherosclerosis in cholesterol-fed rabbits[J]. Agric Food Chem, 2003, 51: 5472-5477.
[11]FULEKI T, FRANCIS F J. Quantitative method for anthocyanins.2. Determination of total antocyanin and degration index for cranberry juice [J]. Food Science, 1968, 33: 78-83.
[12]李升锋, 徐玉娟, 张友胜, 等. 玫瑰茄花青素提取条件优化研究[J].广东农业科学, 2006(11): 83-88.
[13]OSAWA Y. Anthocyanins as food colors[M]. New York: Academic Press, 1982: 85.
[14]冯建光, 谷文英. 葡萄皮红色素的示差法测定[J]. 食品工业科技, 2002, 23(9): 85-86.
[15]刘贤明. 天然食用色素落葵红的初步研究[J]. 食品科学, 1990, 11(8): 9-13.
[16]余华. 玫瑰茄红色素的结构定性研究[J]. 食品科技, 2004(7): 55-60.
Optimizing the Extraction of Red Pigments from Dry Roselle Calyx by Response Surface Methodology
ZENG Zhe-ling,HAO Chun-qing,LU Wei,PENG Chao
(State Key Laboratory of Food Science and Technology, College of Life Science and Food Engineering, Nanchang University, Nanchang 330047, China)
In order to develop an optimal procedure for the extraction of red pigments from dry roselle calyx, single factor method and responses surface methodology (RSM) were applied to study the effects of material/liquid ratio and extraction duration and temperature and their interactions on the total anthocyanin content of the extract. Material/liquid ratio was found to be the most important affecting factor, followed by extraction duration and temperature. The optimal values of the three conditions were determined as follows: material/liquid ratio, 1:24.8; extraction duration, 1.52 h; extraction temperature, 48.74 ℃, and the total anthocyanin content of the extract obtained was 487.6 mg/100 g.
roselle calyx;red pigmente;extraction;response surface methodology
TS264.4
A
1002-6630(2010)20-0047-05
2010-01-21
曾哲灵(1965—),男,教授,博士,研究方向为食物资源开发利用与生物质转化。E-mail:zlzengjx@163.com
