4种食源性致病菌的PCR-SSCP检测技术研究
2009-12-28王永赵新兰青阔朱珠程奕
王 永 赵 新 兰青阔 朱 珠 程 奕
摘要:采用细菌的16S rDNA保守区引物作为通用引物,对常见食源性致泻大肠埃希氏菌(Diarrheogenic Escherichia coli)、沙门氏菌(Salmonellae)、金黄色葡萄球菌(Staphylococcus aureus)和蜡样芽胞杆菌(Bacillus cereus)进行PCR扩增,产物及其Xmn I酶切后产物进行单链构象多态性分析。试验结果显示,4种食源性致病菌的PCR产物经Xmn I酶切后进行单链构象多态性分析可以相互区别。因此,PCR-SSCP技术可以方便地用于检测食源性大肠杆菌、沙门氏菌、金黄色葡萄球菌和蜡样芽胞杆菌。
关键词:食源性致病菌;聚合酶链式反应;单链构象多态性;检测
中图分类号: Q503 文献标识码: A 文章编号:1006-6500(2009)01-0001-0013-03
Study on Detection of Four Kinds of Food-borne Pathogenic Bacteria by PCR-SSCP
WANG Yong,ZHAO Xin,LAN Qing-kuo,ZHU Zhu,CHENG Yi
(Central Lab,Tianjin Academy of Agricultural Sciences,Tianjin 300384,China)
Abstract:In order to establish a detection method for identification of four kinds of food-borne pathogenic bacteria including Diarrheogenic Escherichia coli, Salmonellae, Staphylococcus aureus and Bacillus cereus by using polymerase chain reaction-single strand conformation polymorphism (PCR-SSCP), the bacterial 16S rDNA primers conservative region as a universal primers, PCR product and Xmn I digested products of E.coli, Salmonella, Staphylococcus aureus and bacillus cereus were analyzed by single strand conformation polymorphism. The results showed that four kinds of food-borne pathogens could be distinguished between each other, after digesting the PCR products by Xmn I. So, PCR-SSCP technique can be used to facilitate the detection of food-borne E. coli, Salmonella, Staphylococcus aureus and Bacillus cereus.
Key words: food-borne pathogenic bacteria;PCR;SSCP;detection
食品安全是直接关系到消费者生命、健康和社会稳定的热点问题。食品法典委员会(CAC)将微生物性健康危害列为食源性危害的三大原因之一,我国近年微生物性食物中毒比例高达67%[1]。因此,食源性致病菌的检测与鉴定已成为食品行业不可或缺的关键环节。传统的细菌学检验与鉴定需要进行增菌、分离培养以及生化反应等繁琐步骤,既费时又费力,但对于有些细菌仍无法给出正确的鉴定[2]。随着分子生物学技术的发展,PCR-RFLP、PCR-RAPD、PCR-SSCP、荧光原位杂交技术(FISH)、基因芯片(Microarry)、流式细胞技术(FCM)等技术被广泛用于微生物种群鉴定及临床诊断,上述问题迎刃而解。
聚合酶链式反应-单链构象多态性(PCR-SSCP)技术是建立在PCR基础上的单链构象多态性分析技术。SSCP技术在原理上甚至可以检测出基因片段中单个碱基的差异[3-4]。16S rDNA是细菌相对保守的基因,经常用于细菌分类。本试验旨在探讨以16S rDNA保守区段为PCR扩增对象,运用SSCP技术对致泻大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌以及蜡样芽胞杆菌进行分析,以期为食源性致病菌的快速鉴定提供方法依据。
1材料和方法
1.1 材 料
1.1.1菌株的选择与培养标准菌株选取致泻大肠埃希氏菌、伤寒沙门氏菌、金黄色葡萄球菌和蜡样芽胞杆菌,以上菌株均为ATCC标准菌株,本室保存。菌株复苏后接种于相应的增菌培养基中过夜培养。
1.1.2 主要试剂和仪器PCR引物由上海生工公司合成,Taq酶、dNTP、PCR产物纯化试剂盒等购自Promega公司,Chelex-100购自Sigma公司,限制性内切酶Xmn I购自BBI公司,高速冷冻离心机为Backman公司产品,凝胶电泳设备为BIO-RAD Power 200及Power 1000,PCR扩增仪为Thermo PX2,凝胶成像设备为北京六一公司产品。
1.2 方 法
1.2.1 标准菌株DNA的提取 菌株接种于增菌培养基过夜培养,取培养液100 μL,5 000 r/min离心3 min,弃上清,沉淀用无菌水洗两次,加入100 μL10% Chelex-100,沸水浴5 min,12 000 r/min离心取上清液作为PCR反应的DNA模板[5]。
1.2.2 16S rDNA引物的选择 选择在16S rDNA的保守序列区间(1 170~1 189,1 522~1 540)作为本研究通用引物,引物序列:上游引物 5'-AACTGGAGGAAGGTGGGGAT-3';下游引物 5'-AGGAGGTGATCCAACCGCA-3',扩增产物大小为370 bp[6]。
1.2.3 PCR扩增及PCR反应体系组成 10×PCR反应缓冲液(含Mg2+ )2.5 μL,dNTP溶液(各为10 mmol/μL)0.5 μL,正反引物(10 pmol/μL)各0.5 μL,Taq酶(5 U/μL) 0.5 μL,模板5 μL,水补足反应体系,使总体积为25 μL。循环参数为94 ℃预变性5 min;94 ℃变性40 s,55 ℃复性40 s,72 ℃延伸40 s,30个循环,最后72 ℃延伸5 min。扩增产物于加入EB的2.0% 琼脂糖凝胶上电泳,紫外灯下观察,用DL 2 000做分子量标记。
1.2.4 扩增产物的纯化PCR扩增产物的纯化及酶切 PCR扩增产物的纯化按说明书进行,使用OLIGO 6.0软件分析扩增产物酶切位点情况,选取Xmn I作为本研究使用的限制性内切酶。酶切反应体系:10×酶切缓冲液2 μL,Xmn I 0.5 μL,PCR扩增产物10 μL,补ddH2O至20 μL,37 ℃保温3 h,2%琼脂糖凝胶电泳观测结果。
1.2.5 SSCP分析 5 μL扩增产物或酶切产物与5 μL变性液(5 mmol/L EDTA,0.5 g/L溴酚兰,0.5 g/L二甲基苯青,95%甲酰胺)混匀,沸水浴5 min,迅速置于冰上。取2 μL处理产物上样于8%非变性聚丙烯酰胺凝胶上电泳。电泳条件:电泳槽置于4 ℃,1×TBE,100 V 4 h。电泳结束后进行银染染色并扫描。
2结 果
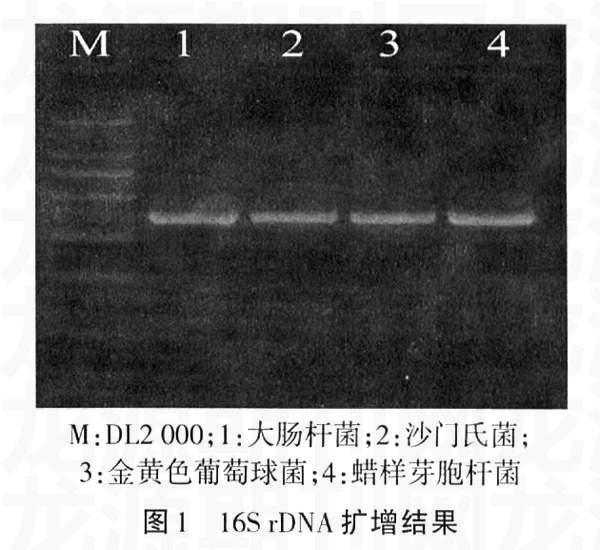
2.116S rDNA基因的通用引物PCR扩增结果
利用16S rDNA基因的通用引物扩增4种食源性致病菌,结果均在370 bp处得到清晰条带,如图1所示。
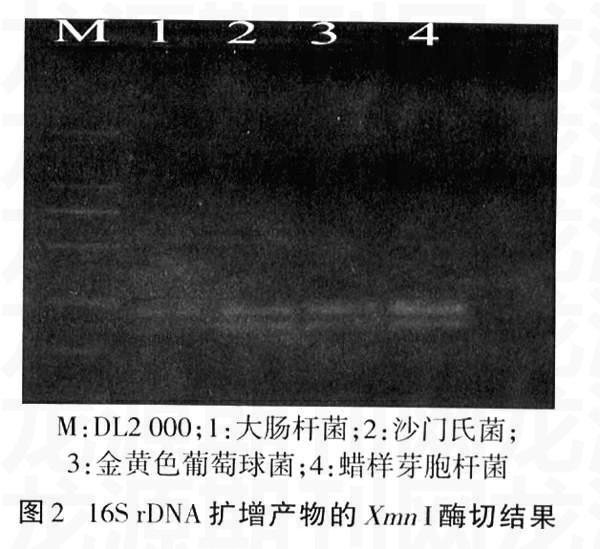
2.2PCR产物酶切结果
4种致病菌16S rDNA保守区段的扩增产物经Xmn I酶切后,结果见图2。从酶切谱图可以看出,本试验所研究的4种致病菌谱带极为相似,具有很高的同源性。
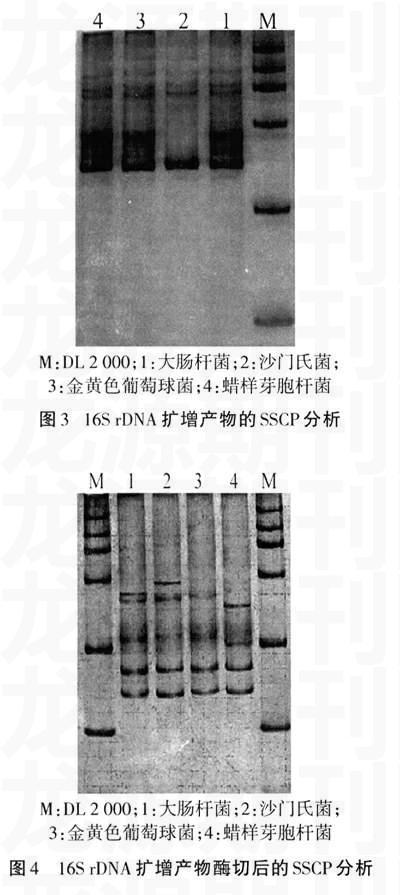
2.3SSCP分析结果
16S rDNA扩增产物直接SSCP分析结果显示,蜡样芽胞杆菌、金黄色葡萄球菌和大肠杆菌SSCP图谱非常相似,如图3所示。16S rDNA扩增产物经Xmn I酶切后的SSCP图谱能够很好地区分大肠杆菌、沙门氏菌、蜡样芽胞杆菌及金黄色葡萄球菌,如图4所示。
3 讨 论
食源性致病菌常用的检测方法就是选择培养基培养和生化鉴定,鉴定过程需要很长时间,而最终的鉴定结果也不一定准确,往往会错失病情控制的时机。本研究通过PCR扩增产物及其Xmn I酶切产物的SSCP分析研究得知,PCR扩增产物的直接SSCP分析不能很好地区分大肠杆菌、沙门氏菌、金黄色葡萄球菌和蜡样芽胞杆菌,而PCR产物经Xmn I酶切后的SSCP分析能够清楚地鉴定上述4种常见食源性致病菌。本研究结果显示,当核酸片段小于250 bp时SSCP分析更利于区分大肠杆菌、沙门氏菌、金黄色葡萄球菌和蜡样芽胞杆菌。以上结果说明,PCR产物酶切后的SSCP分析技术可以方便地用于检测食源性大肠杆菌、沙门氏菌、金黄色葡萄球菌和蜡样芽胞杆菌。
参考文献:
[1] 范宏英,吴清平,吴若菁,等. 饮用水中5种致病菌多重PCR技术检测研究[J].微生物学通报,2005,32(3):102-107.
[2] Gbassan M,Jane E,Georgia Malcolm,et al.Identification of bartonella species directly in clinical specimens by PCR restriction fragment length polymorphism analysis of a 16S rRNA gene fragment[J].J Clln Microbiology,1999, 37:4045-4047.
[3] Ingeborg H,Robert L, Andreas H F,et al. Application of single-strand conformationpolymorphism and denaturing gradient gel elec-rophoresis for fla sequence typing of Campylobacter jejuni [J].Journal of Microbiological Methods, 2003, 52:305-313.
[4] Giraffa G, Rossetti L , Neviani E. An evaluation of Chelex-100 based DNA purification protocols for the typing of lactic acid bacteria[J]. J Microbiol Methods, 2000, 42 (2) : 175- 184.
[5] 李秀萍,尹逊河,吴时友,等. 细菌通用引物在奶牛乳房炎病原菌检测中的作用研究[J].动物医学进展,2005,2 6(4):104-106.
