不同持续时间低氧后训练对大鼠海马组织细胞凋亡的影响
2008-03-14张沙骆瞿树林陈嘉勤
张沙骆 瞿树林 陈嘉勤
(1.长沙民政职业技术学院康复医学系,湖南 长沙 410004;2.湖南师范大学体育学院,湖南 长沙 410012)
摘 要:目的:观察不同持续时间低氧后训练对大鼠海马组织细胞凋亡的影响,探讨低氧训练对海马神经细胞凋亡的影响,为科学地指导运动员进行低氧训练提供实验依据。方法:雄性SD大鼠60只,随机分为6组,每组10只,正常对照组(A组),低氧8 h组(B组),低氧12h组(C组),训练对照组(D组),低氧8 h训练组(E组),低氧12 h训练组(F组)。采用零坡度跑台的训练方式,对D、E和F三组以25 m/min的速度在常氧环境中每天训练1 h。将B、C、E和F组放入低氧舱内,氧浓度为12.5%(相当于4 000 m海拔高度),过8 h和12 h后,分别将B、E组和C、F组取出放入正常氧浓度环境。训练共持续4周,每周5 d。最后一次训练至力竭后24 h断头处死,取大鼠海马组织,测定Bax和Bcl2蛋白表达的阳性细胞个数和凋亡指数。研究结果显示:在低氧训练过程机体对低氧刺激的适应性改变,使得在停止运动后,海马组织的损害减小。随着低氧时间的延长,低氧训练使大鼠海马组织CA1区的细胞凋亡有减少的趋势,从而起到神经保护作用。
关键词:不同持续时间;低氧训练;海马;细胞凋亡
中图分类号:G804.2文献标识码:A文章编号:1007-3612(2008)12-1644-05
On the Effect of Different Hypoxic Training Time in Hippocamus Apoptosis of Rats
ZHANG Sha瞝uo1, QU Shu瞝in2, CHEN Jia瞦in2
(1.Rehabilitation Medicine Department, Changsha Social Work College, Changsha 410004, Hunan China;2.Physical Education College, Hunan
Normal University, Changsha 410012, Hunan China)
Abstract:We examine the effect of hypoxic exercise to rats' hippocampus tissue
apoptosis, and the effect to hippocampus nerve apoptosis, which provide an experimental reference to scientific guidance of hypoxic exercise. We take 60 male SD rats, which are randomly distributed to 6 groups, 10 rats each, which are normal contrast group (Group A), hypoxia 8瞙our group (Group B), hypoxia 12瞙our group (Group C), training contrast group (Group D), hypoxia 8瞙our training group (Group E), hypoxia 12瞙our training group (Group F). Group D, E, F take 1 hour treadmill training in the rate of 25m/min in normal oxygen environment. Then we put B, C, E and F group into hypoxia cabin, oxygen concentration is 12.5% (equal to 4000m altitude), 8 and 12 hours later, put group B, E and C, F into normal oxygen concentration environment separately. This training lasts 4 weeks and 5 days each week. 24 hours after the last training to death, we take hippocampus tissue, proceeding with fixing and tissue embedding, using immunohistochemistry and TUNEL to measure its Bax, Bcl2 and apoptosis index. Conclusion: Increasing the duration of hypoxic period, hypoxic exercise training decrease the apoptosis of cells in rat's hippocampus tissue CA1, which protects the nerves. The hypoxic exercise is due to the change of body's adaptability to hypoxic stimulus. After exercise, the damage to hippocampus tissues also decreases.
Key words: different endurance time; hypoxic exercise; hippocampus; cell apoptosis
自“低氧训练”被提出至今,这种训练方法在竞技体育中已经得到广泛的应用。低氧训练的研究始于血液成分[1]的研究,之后关于心脏功能[2]、肺通气量[3]、骨骼肌代谢[4]等的研究都证明,低氧训练即利用低氧刺激,提高机体转运氧的能力。目前,许多研究者力图从细胞和分子水平阐述低氧训练对机体的影响,并逐步使之成为一个新的研究方向。
由于脑所需能量的85%~95%来自葡萄糖的有氧代谢,而氧气和葡萄糖在脑内的贮存几乎为零,所以脑对缺氧缺血的耐受性很差。其中,对缺血缺氧最为敏感的海马神经细胞,会受到更大的影响。海马是一个补充性运动区,有着躯体定位关系。海马还可通过下丘脑调控垂体的内分泌功能。海马在学习和近期记忆过程中发挥关键作用,刺激海马还可引起某些行为改变,如好静,冷漠及主动性丧失等[5]。
在运动时,机体各部分组织血液供应会重新分配,大量的血液会供给骨骼肌,以维持运动时的供血。在这种情况下,脑组织不可避免地受到缺血缺氧的刺激。当运动停止后,脑组织恢复供血,这从形式上类似于缺血再灌注的过程。已有大量文献证明,缺血再灌注对海马组织细胞凋亡产生很大的影响,甚至会引起功能破坏,组织坏死等[6]。在低氧训练时,机体还要承受外界的低氧环境,那么,脑组织又将如何适应其变化?低氧训练是会进一步诱导还是抑制脑组织的细胞凋亡?脑组织细胞凋亡与不同低氧训练刺激时间的关系是怎样?对于这些问题,目前尚无文献报道。
1 材料与方法
1.1 研究对象及分组
8周龄雄性SD大鼠,体重(200±10)g,共60只(许可证号:scxk(湘)2003-0003),为Ⅱ级实验动物,国家标准啮齿类动物饲料饲养(大鼠及喂养的饲料均购于湖南农业大学实验动物学部)。实验条件:室温20~24℃,相对湿度45%~55%,每天光照12 h,自由饮食、饮水。大鼠随机分为6组,每组10只,分组情况见表1。

本实验以黄丽英等[7]低氧训练模型为依据,采用零坡度跑台的训练方式,对D、E和F三组以25 m/min的速度在常氧环境中每天训练1 h。将B、C、E和F组放入低氧舱内,氧浓度为12.5%(相当于4 000 m海拔高度),过8 h和12 h后,分别将B、E组和C、F组取出放入正常氧浓度环境。训练共持续4周,每周5 d。最后一次训练至力竭后24 h处死(力竭评判方法:连续予大鼠施加声、光、机械刺激后,大鼠不能继续跑动,下跑台后伏地喘息,暂时无逃避反应)。
1.2 实验试剂
速眠新Ⅱ为军事医学科学院军事兽医研究所生产,Bcl-2、Bax和TUNEL试剂盒由Santa Cruz
Biotechnology,INC.研制生产,二抗检测试剂、血清和DAB显色剂由北京中杉金桥生物技术有限公司生产。
1.3 标本制备
4周后处死A组;B组和C组最后一次低氧后24 h即刻分别处死;最后一次训练至力竭后24 h即刻处死D组、E组和F组。采用速眠新Ⅱ(0.8~1.2 mL/kg)腹腔注射,麻醉至理想断头处死,取出前囱后3 mm至上丘平面间包含海马的脑组织块,用生理盐水组织漂洗一下,置入4%多聚甲醛中固定,24 h后常规石蜡包埋待测。
1.4 检测指标及测定方法
1.4.1 苏木精-伊红染色(haematein, HE)
将5 μm海马组织切片经二甲苯浸泡,5 min×3次;入100%、95%、85%乙醇梯度复水,各级2 min;蒸馏水冲洗2 min;放入苏木精染液染色15 min;自来水冲洗15 min;放入1%盐酸乙醇液中分化;自来水流水中冲洗约15 min;放入蒸馏水中漂洗一次;用0.5%伊红染液染色5 min;再依次经70%、85%、95%、100%酒精脱水,各级为2 min;再经二甲苯浸泡,5 min×2次;烤片;封片。
用Motic B5显微摄像系统进行拍照(40×10倍),记录病理变化情况并计分。拟定炎细胞浸润或者脂肪变性为一级,计1分;发现有灶性坏死为二级,计2分;肉芽组织增生为三级,计3分,相加每组各样本分数,进行比较分析。
1.4.2 末端脱氧核苷酸转移酶介导的dUTP缺口末端标记法(terminal deoxynucleotydyl transferase-mediated dUTP nick end labeling, TUNEL)
将5 μm海马组织切片于二甲苯中浸泡2次,5 min/次;置于100%、95%、85%乙醇溶液中各2
min复水;自来水冲洗;蒸馏水冲洗2次,每次间隔5 min;PBS冲洗3次,每次间隔5 min;柠檬酸pH6.0先预热3 min(350 w),放入切片(350 w),5 min到温度80℃,加温到95℃后维持5 min;3%H2O2室温孵育10 min;蒸馏水冲洗2次,每次间隔5 min;PBS冲洗2次,每次间隔5 min;试剂准备:从2号瓶中取出100 μL至两个阴性对照组,将1号瓶中取出50
μL加入到2号瓶中,混合后正好是500 μL并盖上盖玻片,放入滴加甘油的湿盒中,37℃孵育1
h;PBS冲洗3次,每次间隔5 min;加入转化剂POD试剂37℃30 min并盖上盖玻片,37℃孵育30 min;PBS冲洗3次,每次间隔5 min;DAB显色5 min;自来水冲洗;苏木素复染4 min;自来水冲洗;1%盐酸酒精分色梯度酒精脱水:自来水冲洗;烤片;封片。
在普通光学显微镜观察,阳性凋亡细胞表现为细胞核呈棕色或棕褐色着染,部分胞浆也可因胞核DNA碎片溢出而呈阳性着染;正常非凋亡细胞和阴性对照细胞核被苏木素复染成蓝色,核相对较大,形态大小一致。每张切片光镜(40×10倍)观察10×500个细胞,计算每100个细胞中的平均阳性凋亡细胞数,即凋亡指数。用Motic B5显微摄像系统和MIAS医学图像分析系统进行摄像计数。
1.4.3 免疫组织化学染色
将5 μm海马组织切片于二甲苯5 min×2次;置于100%、95%、85%乙醇中各2 min复水;自来水冲洗;3%H2O2室温孵育10 min;蒸馏水冲洗;PBS浸泡5 min;将切片浸入柠檬酸酸盐抗原修复液(pH6.0)后放入微波炉中加热15 min,间断2 min后,再加热5 min;室温冷却后经PBS冲洗,5 min×3次;正常山羊血清封闭,室温孵育10 min,倾去;滴加一抗(Bcl-2和Bax均为1∶50);4℃湿盒过夜;次日取出恢复室温后,PBS冲洗5 min×3次;滴加二抗工作液,37℃孵育30 min;PBS冲洗5 min×3次;DAB显色5 min;自来水冲洗;苏木素复染4 min;自来水冲洗;1%盐酸酒精分色:自来水冲洗;烤片;封片。
在光学显微镜(40×10倍)下每张切片随机观察6个视野,用Motic B5显微摄像系统和MIAS医学图像分析系统进行摄像分析,统计场面积均为15 554 584.02 μm2。
1.5 统计学分析
用SPSS13.0统计学软件分析,实验数据以平均数±标准差(X±S)表示,采用析因设计方差分析进行统计分析,显著性水平取α=0.05。
2 结 果
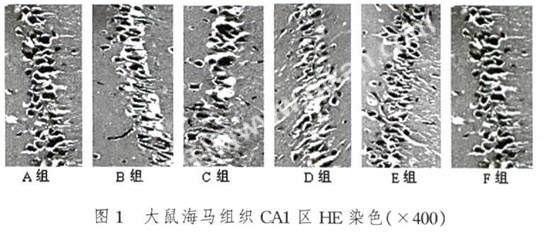
2.1 大鼠海马组织CA1区HE染色结果
光学显微镜下,细胞核呈蓝黑色,胞浆呈淡红色。A组SD大鼠海马CA1区可见数层锥体神经元,细胞形态规则,排列整齐紧密;其它各组中,从形态学观察有不同程度的病理改变,如海马CA1区锥体神经元出现核固缩、胞质浓缩、细胞体急剧变小等现象,以此判断可能有细胞凋亡的发生。D组的病理改变最为明显其排列散乱,层次不完整,稀疏分布不均匀,其细胞肿胀,核染色体染成很淡的蓝色甚至有些细胞消失(图1)。大鼠海马组织CA1区HE染色结果采用分级计分的方式进行了比较分析(表2)。

2.2 海马组织CA1区TUNEL结果
运用TUNEL进行标记,凋亡细胞形态呈圆形或椭圆形。凋亡细胞核呈棕色或棕褐色着染,形态呈碎点状,不规整,大小不一致。正常非凋亡细胞的细胞核被苏木素复染呈蓝色,核相对较大,形态大小较为一致(图2)。
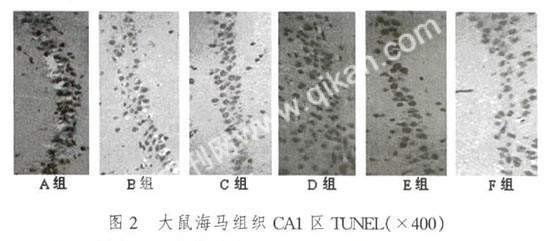
通过计算凋亡指数发现,A组的凋亡指数极低为1%。B组和C组的凋亡指数依次增高,分别为18%和25%。D组的凋亡指数最高,高达32%。E组和F组的凋亡指数又依次降低,分别为20%和15%。
2.3 海马组织CA1区免疫组织化学结果
2.3.1 海马组织CA1区Bax免疫组织化学结果
光学显微镜下观察大鼠海马CA1区的神经细胞,Bax的表达产物呈棕黄色或棕褐色颗粒状,胞浆和胞核均有着色。A组仅有少量阳性细胞表达。在B组和C组中,阳性细胞的个数和排列紧密程度随着低氧时间的延长逐一增高,而E组和F组的变化规律与之相反。D组的阳性细胞最为集中密集分布(图3)。
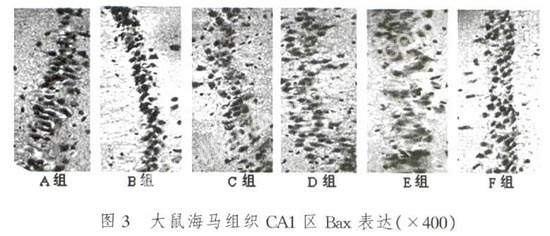
训练组与不训练组的大鼠海马组织CA1区Bax阳性细胞个数相比,差异有统计学意义(F=14.696,P<0.01),训练组高于不训练组;不同持续时间低氧组的Bax阳性细胞数之间比较,差异有统计学意义(F=9.888,P<0.01),经两两比较,低氧12 h组高于低氧0 h组和低氧8 h组;不同持续时间低氧后训练组的Bax阳性细胞数之间比较,差异有统计学意义(F=209.975,P<0.01),随着低氧持续时间延长,Bax的阳性细胞数有下降趋势,训练和低氧两因素间存在交互作用(表3、4、5)。
2.3.2 大鼠海马组织CA1区Bcl-2免疫组织化学结果
光学显微镜下观察大鼠海马CA1区的神经细胞,Bcl-2的表达产物呈棕黄色或棕褐色颗粒状,胞浆和胞核均有着色。A组表达的阳性细胞数量和颜色相对其他组而言都比较多。在B组和C组中,阳性细胞的个数和排列紧密程度随着低氧时间的延长逐一降低,而E组和F组的变化规律与之相反。D组的阳性细胞最为稀疏分布(图4)。

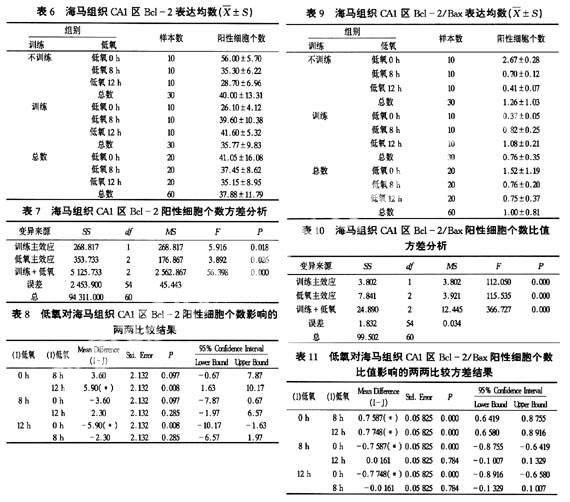
训练组与不训练组的大鼠海马组织CA1区的Bcl-2阳性细胞数相比,差异有统计学意义(F=5.916,P<0.05),不训练组高于训练组;不同持续时间低氧组的Bcl-2阳性细胞数之间比较,差异有统计学意义(F=3.892,P<0.05),经两两比较,低氧12 h组低于低氧0 h组;不同持续时间低氧后训练组的Bcl-2阳性细胞数之间比较,差异有统计学意义(F=56.398,P<0.01),随着低氧持续时间延长,Bcl-2的阳性细胞数有上升趋势,训练和低氧两因素间存在交互作用(表6、7、8)。
2.3.3 大鼠海马组织CA1区Bcl-2/Bax结果
训练组与不训练组的大鼠海马组织CA1区的Bcl-2/Bax阳性细胞个数比值相比,差异有统计学意义(F=112.050,P<0.01),不训练组高于训练组;不同持续时间低氧组的Bcl-2/Bax阳性细胞个数比值之间比较,差异有统计学意义(F=115.535,P<0.01),经两两比较,低氧8 h组和低氧12 h组低于低氧0 h组;不同持续时间低氧后训练组的Bcl-2/Bax阳性细胞个数比值之间比较,差异有统计学意义(F=366.727,P<0.01),随着低氧作用的时间延长,Bcl-2/Bax阳性细胞个数比值有上升趋势,训练和低氧两因素间存在交互作用(表9、10、11)。
3 分析与讨论
细胞凋亡是一个主动的由基因决定细胞自我破坏的过程,并受到严格的由遗传机制决定的程序性调控[8]。细胞内的基因直接控制着细胞凋亡的发生和发展,细胞外部因素通过信号转导而影响这些基因的表达或其表达产物的活化,从而间接地调控细胞凋亡[9]。细胞凋亡是消除体内衰老细胞群的机制之一,其伴随着机体的成熟与衰老。
Bcl-2蛋白家族直接控制着线粒体外膜通透性的改变,是神经元死亡调控机制中最关键的蛋白家族之一[10]。但Bcl-2不能单独作用抑制细胞凋亡,其活性受相关蛋白Bax的调节。Bax是Bcl-2家族中最重要的死亡促进基因,Bax基因的作用是拮抗Bcl-2,促进细胞凋亡。Bcl-2蛋白的抑制凋亡作用必须通过与Bax形成异源二聚体(Bcl-2- Bax)来实现。而Bax形成同源二聚体(Bax-Bax)则可诱导细胞凋亡[11]。Bcl-2蛋白和Bax的比值决定细胞是存活还是凋亡,Bcl-2/Bax比值高,细胞存活率高,反之,细胞凋亡率高[12]。
3.1 运动训练对海马组织细胞凋亡的影响
本研究发现,经4周耐力训练再力竭运动后,训练组海马CA1区Bax的表达较不训练组高,而Bcl-2的表达较不训练组低,Bcl-2/Bax比值较不训练组明显下调,凋亡细胞数增多。在运动时,机体各部分组织血液供应会重新分配,大量的血液会供给骨骼肌,以维持运动时的供血。在这种情况下,对于脑及其它组织而言,不可避免地遭受缺血缺氧。在运动停止后,大脑组织再次经历血液重新分配,这从形式上类似于缺血再灌注的过程。目前研究发现,缺血脑组织的迅速再灌注对正常功能的恢复至关重要。然而这种血流恢复反而会引起可逆受损细胞的进行性破坏,即再灌注损伤问题,导致缺血组织损伤恶化,如较缺血组而言,增加了梗死面积和体积[13]。这种再灌注损伤由多种原因引起,与氧化损害密切相关,但具体机制仍不明确。研究表明,再灌注损伤的机制主要集中于启动自由基连锁反应,氧自由基可通过引起细胞脂质过氧化、损伤DNA分子或者调节细胞凋亡相关基因而诱导细胞凋亡,而过度形成导致神经细胞损伤[14]。
许多研究证实神经元在经历了缺血再灌注后,在缺血敏感区会发现细胞凋亡,如海马CA1区出现的延迟性神经元死亡,其表现出明显的凋亡特征,如核固缩,DNA片断化,膜泡化等,并可检测到凋亡特征性DNA梯状条带[15]。脑缺血再灌注后海马神经元凋亡的发生与缺血的方式、严重程度、再灌注时间的长短等因素有关[16]。虽然目前对于细胞凋亡和相关蛋白出现和消亡的时间结果报道不一,但都基本认为,在再灌注24 h后,Bcl-2和Bax的表达均可达到高峰,并也伴随着大量的细胞凋亡,提示在此时损伤较为严重[17]。
3.2 低氧对海马组织细胞凋亡的影响
在低氧环境中,机体乳酸生成增多,使红细胞脆性增加,破坏增多;但经过一段时间后,由于机体的应激反应,对低氧环境产生一系列适应,如增加了RBC数目、Hct和Hb含量等,这些指标的上升反映机体携氧能力的提高[18]。由此推测,在进入常氧环境后的,机体在安静状态下的携氧能力提高,进入组织的氧增多,这必然导致氧自由基生成增多。由于神经元细胞器的膜结构均为脂质膜,使得组织细胞更易发生脂质过氧化而造成损伤[19]。
研究证明,高浓度氧导致神经元超级微结构损伤。高氧3 d后,神经元的线粒体、内质网、高尔基复合体开始出现损伤性变化,随着处置次数增加,损伤逐渐加重,由肿胀到膜结构明显破坏,胞质内出现空泡、脂粒,粗面内质网脱颗粒[20]。本实验结果证明,经4周氧浓度为12.5%(相当于4 000 m海拔高度)后,低氧0 h组、低氧8 h组和低氧12 h组大鼠海马CA1区的Bax之间比较,且随着低氧持续时间的延长,表达越高;Bcl-2的表达随着低氧持续时间的延长,表达降低,Bcl-2/Bax比例随着低氧持续时间延长明显下调,凋亡细胞数增多。
3.3 低氧训练对大鼠海马组织细胞凋亡的影响
本研究结果表明,4周低氧训练后,随着低氧持续时间的延长,训练对照组、低氧8 h训练组和低氧12 h训练组海马组织CA1区的Bax表达依次增高,而Bcl-2表达和Bcl-2/Bax比值依次降低,凋亡细胞数随低氧持续时间的延长有减少的趋势,推测这种现象是由于机体对低氧刺激的适应性改变,在低氧训练的运动过程中,机体的携氧能力较单纯运动组提高,当然海马组织的缺氧情况较运动组轻。这使得在停止运动后,再灌注的缺氧再复氧的变化幅度也比单纯运动组小得多,海马组织在这个过程的损害也减小,表现为低氧8 h训练组和低氧12 h训练组的细胞凋亡数较训练对照组表达均有降低,且随着低氧适应的时间延长,有减少的趋势。
在临床医学中,这种1次或多次短暂的轻度缺氧后,可触发机体内源性的保护机制,对随后发生的严重缺血缺氧产生耐受性的现象,称为低氧预适应[21]。研究表明,将大鼠置于8%O2 3 h后再缺血再灌注组与单纯的缺血再灌注组比较发现,从再灌注后6 h开始到48 h,低氧预适应组Bcl-2的表达显著高于缺血再灌注组、Bax的表达显著低于缺血再灌注组,且Bcl-2/Bax比值在48 h时,仍然处于较高水平,且Bcl-2/Bax比值的变化与神经功能的恢复及对凋亡的抑制相关[22]。Miller等[23]报道,2 h的缺氧预适应,可使其后缺血再灌注48 h的大脑中动脉梗死面积减少46%~64%。这些报道说明低氧预适应可有效减少脑缺血再灌注后的脑损伤。低氧预适应从而起到神经保护作用。这是一个多因素、多环节、多途径的复杂过程,各种可能机制在神经元凋亡中所占的比重及相互关系有待进一步研究。
参考文献:
[1] Grassi B, Ferretti G, Kayser B, et al. Maximal rate of blood lactate accumulation during exercise at altitude in humans[J].J Appl Physiol,1995,79(1):331-339.
[2] 黄丽英,林文,翁锡全.常压模拟高住低练对大鼠心肌低氧诱导因子1α基因表达的影响[J].中国运动医学杂志,2004,23(2):133-135.
[3] Levine BD, Friedman DB, Engfred k, et al. The effect of normoxic or hypobaric hypoxic endurance training on the hypoxic ventilatory response[J]. Med Sci Sports Exerc,1992,24(7):769-775.
[4] 王荣辉,刘桂华,胡琪,等.低氧训练对大鼠骨骼肌乳酸脱氢酶和苹果酸脱氢酶活性的影响[J].北京体育大学学报,1998,21(3):31-32.
[5] 万选才,杨天祝,徐承焘.现代神经生物学[M].北京:北京医科大学中国协和医科大学联合出版社,1999.474-475.
[6] 孙永海,岳云,王云.再灌注吸入异氟醚对不同程度大鼠脑缺血再灌注损伤的影响[J].中华麻醉学杂志,2004,24(12):901-904.
[7] 黄丽英.间歇低氧训练对大鼠氧化应激及其低氧适应机制的研究[D].华东师范大学学位论文,2003.
[8] 翟中和,王喜忠,等.细胞生物学[M].北京:高等教育出版社,2000.454-466.
[9] 查锡良.医学分子生物学[M].北京:人民卫生出版社,2003.515-26.
[10] Orrenius S. Mitochondrial regulation of apoptotic cell death[J ]. Toxicol Lett,2004,149(123):19223.
[11] Kaneda K, Kashii S, Kurosawa T, et al. Apoptotic DNA fragmentation and upreulation of Bax induced by transient ischemia of the rat retina[J]. Brain Res,1999,815(1):11-20.
[12] Zhu Y, Prehn J, Culmsee C, et al. The beta2-adrenoceptor agonist clenbuterol modulates Bcl-2, Bcl-xl and Bax protein expression following transient forebrain ischemia [J]. Neurosci,1999,90(4):1255-1263.
[13] 毛颖,周良辅,杨国源.局灶性脑缺血后脑内髓过氧化物酶活性观察[J].中国神经精神疾病杂志,1999,25(6):343-345.
[14] Kidwell CS, Saver JL, Mattiello J,et al. Thrombolytic reversal of acute human cerebral ischemic injury shown by diffusion/perfusion magnetic resonance imaging[J]. 2000,47(4):462-469.
[15] 赵红岗,李文斌,孙晓彩,等.c-fos在肢体缺血预处理抗脑缺血再灌注损伤中的作用[J].中华老年心脑血管病杂志,2006,16(11):56-59.
[16] Graham SH, Chen J. Programmed cell death in cerebral ischemia[J]. J Cereb Blood Flow Metab,2001,21(2):99-109.
[17] 龚洁,丁新生,印卫兵,等.巴曲酶对缺血再灌注后凋亡相关基因时效研究[J].中国临床医学,2005,12(4):726-728.
[18] 周桔,瞿树林,汤长发,等.常压模拟高住低练对大鼠RBC、Hb及HCT的影响[J].中国体育科技,2007,30(1):121-123.
[19] 高春锦,杨捷云主编.实用高压氧医学[M].北京:学苑出版社,1997.
[20] 刘燕,鲍锦华,赖晃文,等.高压氧对正常大鼠海马神经元结构的影响[J].第三军医大学学报,2000,22(7):664-666.
[21] Wick A,Wick W,Waltenberger J, et al. Neuroprotection by hypoxic preconditioning requires sequential activation of vascular endothelial growth factor receptor and Akt [J]. J Neurosci,2002,22(15):6401-6407.
[22] 高晓群,段东晓,邢莹,等.低氧预适应对大鼠脑缺血再灌注神经细胞凋亡及Bcl-2、Bax表达的影响[J].郑州大学学报,2004,39(5):810-812.
[23] Miller BA, Perez RS, Shah AR, et al. Cerebral protection by hypoxic preconditioning in a murine model of focal ischemia-reperfusion[J].Neuroreport,2001,12(8):1663-1669.
